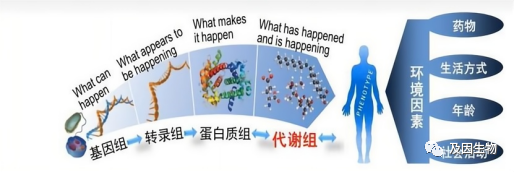
基因制约着每个生命个体的一切生命活动,生物体的生、老、病、死等一切生命现象都与基因有关。对基因组的结构、功能等展开的研究我们称为基因组学,基因通过转录形成RNA的过程我们称为转录组学,RNA可以翻译蛋白质,这个过程就是蛋白质组学,蛋白质可以催化产生或作用于代谢产物,也就是代谢组学。
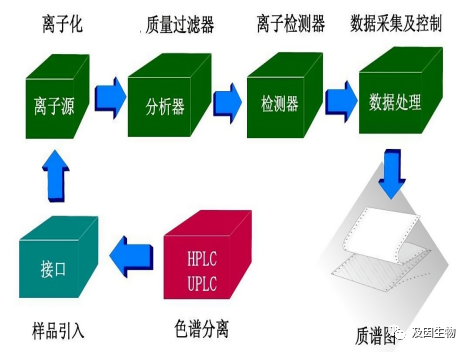
质谱仪是如何检测蛋白质的
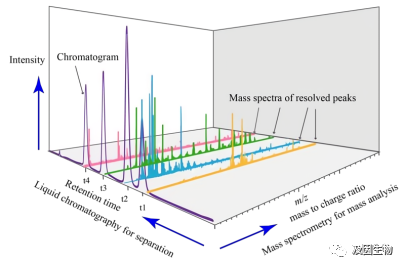
那么接下来我们详细了解一下:
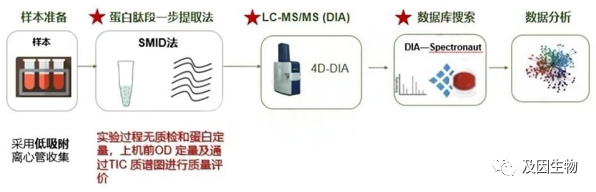
那么我们通过一级质谱了解到了蛋白质的相对含量,但这些蛋白质都是什么蛋白呢,这就需要我们的二级质谱对蛋白质进行定性。
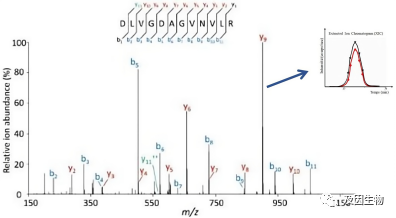
二级质谱主要用于定性分析,其基本原理是将一级质谱中分离出的母离子进一步裂解,得到二级离子。这些二级离子可以提供关于目标化合物的更多信息,如分子结构、化学键等。通过对比已知的二级离子谱图或者利用化学计量学方法对二级质谱数据进行解析,可以确定目标化合物的结构,对蛋白质进行定性,告诉我们有哪些蛋白质。
蛋白质组学主要研究的目的主要包括:哪些蛋白质表达、蛋白质的表达量变化、蛋白的翻译后修饰、蛋白与蛋白之间的相互作用等。
按照不同的划分模式,可以将蛋白质组学分为:蛋白质定性、相对定量蛋白质组、全息扫描蛋白质组学、靶向蛋白质组学和微量蛋白质组学。

蛋白质定性(Shotgun鸟枪法)
Shotgun(鸟枪法)是鉴定蛋白质混合物中蛋白质组成的常见方法。Shotgun的原理是蛋白在经过蛋白胰酶酶解后形成肽段,然后通过高效液相色谱分离,并进入质谱检测。通过二级质谱中肽段碎裂片段的信号分布与理论肽段碎裂片段的比对,实现对肽段的定性(氨基酸序列认定),最终实现对蛋白质的定性鉴定。
应用方向:蛋白胶点胶条鉴定、相互作用蛋白鉴定、全蛋白质组鉴定。技术特点:
1. 适合各类样本的蛋白质鉴定:尤其适合对蛋白电泳考染胶条或银染胶条(银染试剂需与质谱兼容)、IP/CO-IP/Pull-Down洗脱液等样本中蛋白质的鉴定;
2. 样本要求低:由于仅进行蛋白质定性鉴定而不进行定量,因此微量样本即可满足实验要求。
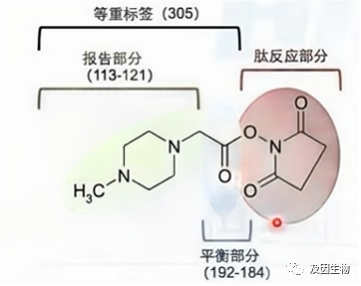
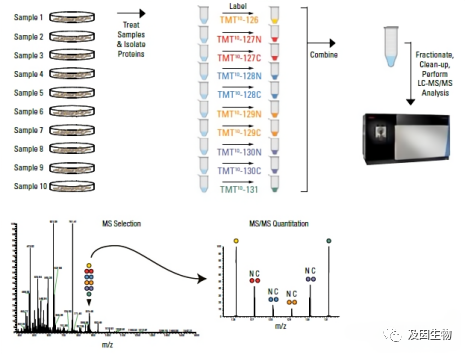
标记定量蛋白质组学是利用化学试剂与蛋白质或多肽的N端或赖氨酸残基进行共价结合,实现对蛋白质或多肽的标记。主要包括:iTRAQ和TMT,他们的原理基本相似,主要区别在于可以同时检测的样本数量不同,iTRAQ采用4、6、8种同位素标签,一种标签可以标记一个样本,TMT采用6、10、16、18种同位素标签,可同时比较多达18种样品之间的蛋白质表达量。
技术特点:
1. 定量准确,高可重复性:不同样本的肽段经标记后等量混合,统一分级并上机检测,避免了非标记蛋白质组学单独样本上机可能带来的误差,显著提高定量准确性和重复性;
2. 更高的鉴定深度:相比传统3D label free,蛋白鉴定数提高20%~50%;鉴定能力与4D label free相当;
3. 不适合蛋白质总量极低的样本分析,不适合进行蛋白质绝对有无的差异比较分析。
与iTRAQ和TMT的多肽体外标记定量技术不同,Label free属于非标记定量蛋白质组学,无需使用昂贵的稳定同位素标签做内部标准,每个样品单独上机,只需分析大规模鉴定蛋白质时所产生的质谱数据,比较不同样品中相应肽段的信号强度,从而对肽段对应的蛋白质进行相对定量。
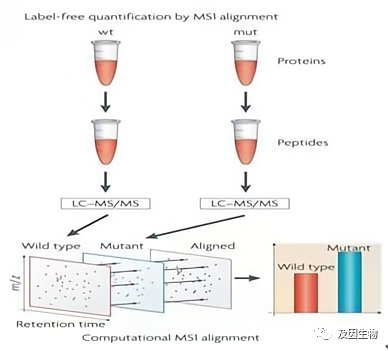
技术特点:
1.无需依赖同位素标记,每例单独检测,因此实验设计灵活,适合临床大样本,几十例、上百例样本的检测,能检测到样本中绝对的“有还是无”的蛋白。
2. 对仪器的稳定性、实验人员的操作等可能产生系统误差的因素要求极高。
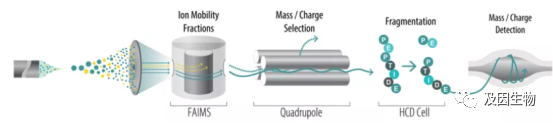
DDA(数据依赖性采集)与DIA(数据非依赖性采集)是质谱分析中常用的二级质谱数据采集模式。我们知道,一级质谱可以对蛋白质定量,二级质谱可以定性,DDA是选择性数据采集方式,是一种质谱内部的选择过程。它能根据当前扫描到的所有母离子的信号强度来决定哪一个会最终进入二级碎裂。相对定量蛋白质组学中iTRAQ、TMT和Label-free都是基于DDA模式。通俗来说,在一级质谱中我们可以根据离子峰的面积判断母离子的丰度,DDA模式通常会选择一级质谱中丰度前10-20的母离子进行破碎,打印二级质谱进行定性,也就是DDA模式不采集所有离子信息,那么一些丰度低的蛋白难免就会遗漏,由于二级质谱的检测是依赖于一级质谱的数据,因此也被称为数据依赖性采集模式。
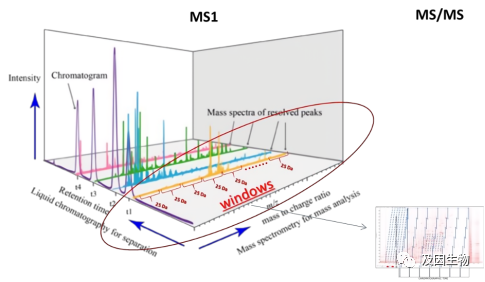
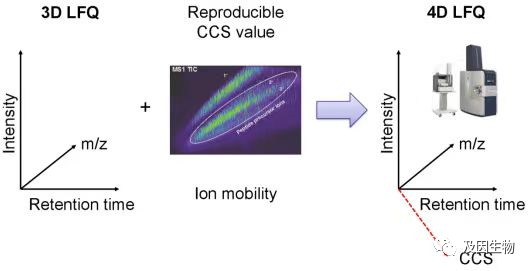
常规蛋白质组学通常是从三个维度:离子强度(Intensity)、保留时间(Retention time)和质荷比(m/z)对蛋白质进行定性与定量。那么在检测的过程中一些质荷比(m/z)比较接近的肽段和同分异构体肽,质谱在检测时很容易会认为是同一种,从而造成遗漏。相对于传统蛋白质组学技术,基于timsTOF Pro2的4D-蛋白质组学平台,在前三个维度的基础上增加了第四个维度,离子淌度(mobility)可以对离子的形状和截面进行分离,能够区分m/z差值非常小的离子,大幅度提高扫描速度和检测灵敏度。
技术特点:
1.更高的鉴定深度:助力更多肽段和蛋白的鉴定,蛋白鉴定数提高50%~100%;2.更适合微量样本:比常规TMT技术要求的送样量少50%~80%,能够满足临床珍贵、微量样本的蛋白组分析需求;
3.更高的准确度:离子淌度能够有效区分共洗脱肽段/同分异构体肽,比传统label free技术鉴定结果更可靠、准确。
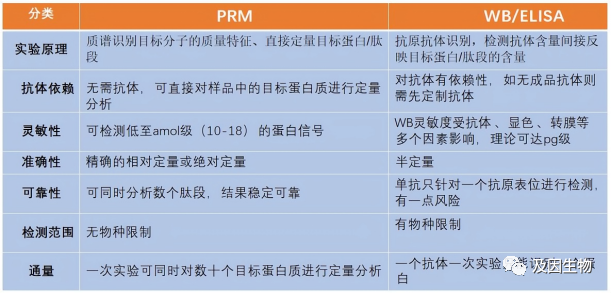
Parallel Reaction Monitoring(PRM,平行反应监测技术)是一种针对目标蛋白质进行定量检测的靶向质谱技术。通过对特异性肽段或目标肽段进行选择性检测,从而实现对目标蛋白质/修饰肽段的靶向相对或绝对定量。由于PRM技术不依赖于抗体,且能在单次检测中实现几十种甚至上百种蛋白质的定量,因此,PRM是目前进行大规模样本或者大量蛋白质验证的优先推荐技术。
PRM与WB/ELISA的对比:
微量蛋白质组学
基于质谱的蛋白质组学方法能够实现对蛋白质的定性和定量,以及复杂样本中的翻译后修饰测定,但是,常规的蛋白质组学需要大量样本,比如细胞需要5×106,组织需要30mg。对于一些特殊的样本类型,比如流式分选的细胞、原代培养细胞,以及一些临床穿刺组织、玻璃体等,这些样品类型珍贵、不易获取、样本量少,往往达不到常规蛋白质组学对于样本量的要求。微量蛋白质组学能够对蛋白肽段进一步提取,结合4D-DIA全息扫描技术实现对微量样本深度检测的蛋白质组学。