前言
1 范围
本标准规定了尿液中Δ9-四氢大麻酸的液相色谱-串联质谱(LC-MS-MS)检测方法。
本标准适用于尿液中 -四氢大麻酸的定性分析和定量分析。
2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682 分析实验室用水规格和试验方法
GA/T 122 毒物分析名词术语
3 术语和定义
GA/T 122 界定的术语和定义适用于本文件。
4 原理
尿液中Δ9-四氢大麻酸在碱性条件下水解,然后在酸性条件下用有机溶剂萃取,采用液相色谱-串联质谱法进行检测。
5 试剂或材料
所用的试剂,除特别注明者外均为分析纯试剂;水为符合GB/T6682规定的一级水;试剂和材料包括:
a) 正己烷。
b) 乙酸乙酯。
c) 乙腈:HPLC级。
d) 甲酸:优级纯。
e) 乙酸铵:色谱纯
f) 冰乙酸:优级纯。
g) 20mmol/L乙酸铵溶液:取乙酸铵1.54g,置1000mL量瓶中,加水适量,加入甲酸2.0mL,加水至刻度,摇匀。
h) 1mol/L氢氧化钠溶液:取氢氧化钠4.0g,加水100mL溶解。
i) 1mol/L盐酸溶液:取浓盐酸20.8mL,加水稀释至250mL。
j) Δ9-四氢大麻酸对照品溶液:市售100μg/mL甲醇溶液,置冰箱中冷冻保存。保存时间为12个月。
k) Δ9-四氢大麻酸对照品工作溶液:试验中所用其他浓度的对照品溶液均从上述对照品溶液用甲醇稀释得到。密封,置于冰箱中冷藏保存。保存时间为3个月。
l) 内标物 Δ9-四氢大麻酸-d9对照品溶液:市售100μg/mL甲醇溶液,置冰箱中冷冻保存。保存时间为12个月。
m) 内标物 Δ9-四氢大麻酸-d9对照品工作溶液:将内标对照品溶液用甲醇稀释,配制成10μg/mL的工作溶液,密封,置于冰箱中冷藏保存。保存时间为3个月。
n) 具塞玻璃试管。
o) 精密pH试纸。
6 仪器设备
仪器设备包括:
a) 液相色谱-串联质谱仪,配有电喷雾离子源(ESI)。
b) 涡旋振荡器。
c) 离心机。
d) 恒温水浴锅。
e) 精密移液器:10μL~100μL、100μL~1000μL。
f) 电子天平。
7 检测步骤
7.1 定性分析
7.1.1样品提取
精密量取待测样品尿液1mL,加人1mL的1mol/L氢氧化钠溶液调至pH 13, 80 ℃水浴中水解30min,冷却后加入1mL的1mol/L盐酸溶液调至pH 7~8,再加入100μL冰乙酸,调至pH 4~5,加人3mL正己烷:乙酸乙酯(9:1),混旋,离心,吸取上清液,60℃水浴空气流下吹干,残留物中加入200μL乙腈:20mmol/L乙酸铵溶液(9:1)定容,取5μL供LC-MS/MS检测。
7.1.2添加样品及空白样品
取空白尿液样品ImL两份,一份添加 Δ9-四氢大麻酸工作溶液制得15ng/mL添加样品,一份做阴性对照,按上述操作与待测样品平行提取和分析。
7.1.3仪器检测
7.1.3.1液相色谱-串联质谱仪参考条件
以下为参考条件,按照本法所获得的液相色谱-串联质谱图参见附录A中的图A.1,可根据不同品牌仪器和不同样品等实际情况进行调整:
a) 色谱柱: MG Ⅱ C 18,3 μm, 50mm×3mm(内径)或相当者;
b) 柱温:室温;
c) 流动相:乙腈:20mmol/L乙酸胺和0.1%甲酸缓冲液(9:1);
d) 流速:200μL/min;
e) 进样量:5μL;
f) 离子源:ESI,负离子模式;
g) 离子喷雾电压:4000V;
h) 离子源温度:450℃;
i) 检测方式:多反应监测(MRM);
j) 碰撞气、气帘气等气流值应优化至最优灵敏度;
k) Δ9-四氢大麻酸和内标物的定性离子对、定量离子对、去簇电压和碰撞能量见表1。
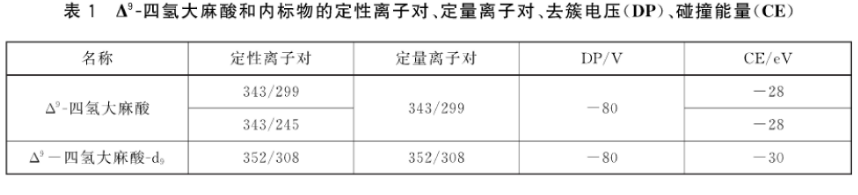
在相同的试验条件下,待测样品中出现两对定性离子对色谱峰,其保留时间与添加样品中 Δ9 -四氢大麻酸保留时间比较,相对误差在±2.5%内,且相对离子对丰度比与质量浓度相近添加样品中的相对离子对丰度比之相对误差不超过表2规定的范围,则可判断样品中存在Δ9-四氢大麻酸。

在系列浓度的 -四氢大麻酸添加样品中,以Δ9 -四氢大麻酸与内标物定量离子对的峰面积比(Y)为纵坐标、Δ9-四氢大麻酸质量浓度(C)为橫坐标进行线性回归,得线性方程。
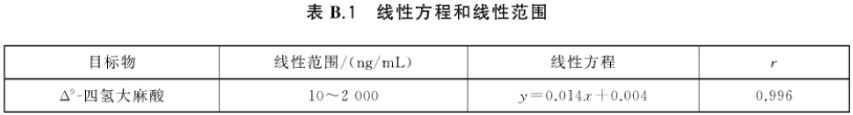
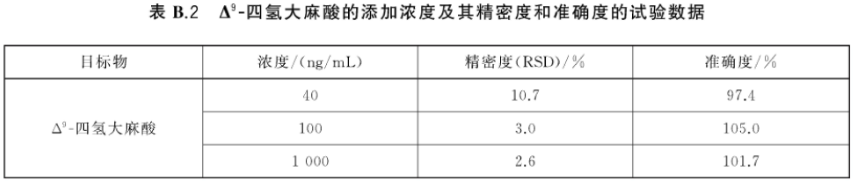
根据待测样品中Δ9-四氢大麻酸及内标物定量离子对的峰面积值,按式(1)计算出待测样品中△四氢大麻酸的质量浓度。Δ9-四氢大麻酸的线性、准确度和精密度的试验数据参见附录B中的表B.1和表B.2。
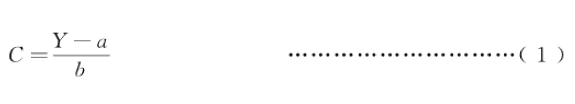
C —待测样品中Δ9-四氢大麻酸的质量浓度,单位为纳克每毫升(ng/mL);
Y ——待测样品中Δ9-四氢大麻酸与内标物定量离子对的峰面积比;
a ——线性方程的截距;
b —线性方程的斜率。
7.2.5平行试验
待测样品同时平行测定两份,双样相对相差按式(2)计算:

式中:
RD —相对相差;
C1、C2 —两份待测样品平行定量测定的质量浓度,单位为纳克每毫升(ng/mL);
8 分析结果评价
8.1 定性结果评价
8.1.1 阴性结果评价
若添加样品中检出Δ9-四氢大麻酸成分,待测样品中未检出Δ9-四氢大麻酸成分,则阴性结果可靠;若添加样品中未检出Δ9 -四氢大麻酸成分,则阴性结果不可靠。
8.1.2 阳性结果评价
若待测样品中检出 Δ9-四氢大麻酸成分,且空白样品无干扰,则阳性结果可靠;若待测样品中检出Δ9-四氢大麻酸成分,且空白样品亦呈阳性,则阳性结果不可靠。
8.2 定量结果评价
若待测样品中Δ°四氢大麻酸质量浓度的双样相对相差小于或等于20%,定量数据可靠,其质量浓度按两份样品的平均值计算。若待测样品中△°-四氢大麻酸质量浓度的双样相对相差大于20%,定量数据不可靠,应按7.2重新提取检验。
8.3检出限和定量下限
本标准尿液中Δ9-四氢大麻酸的检出限为4 ng/mL,定量下限为10 ng/mL。
附录A
(资料性附录)
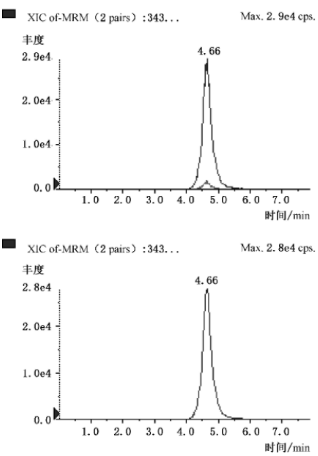
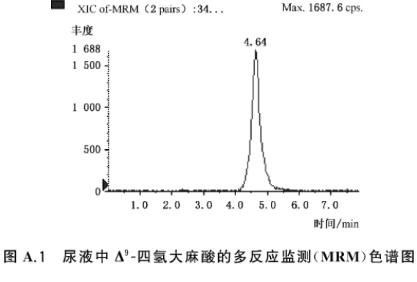
Δ9-四氢大麻酸的多反应监测(MRM)色谱图
Δ9-四氢大麻酸的多反应监测(MRM)色谱图,见图A.1。
附录B
(资料性附录)
线性、精密度和准确度
B.1 Δ9-四氢大麻酸的线性方程和线性范围见表B.1。
B.2 Δ9-四氢大麻酸的添加浓度及其精密度和准确度的试验数据,见表B.2。
如需原件,可在下方留言并附上邮箱,我们将会邮件发送!
来源:国家卫生健康委员会,如有侵权,请联系删除!















