中国老年保健医学研究会检验医学分会中国老年医学学会检验医学分会
中华检验医学杂志, 2021,44(7) : 587-595.
DOI: 10.3760/cma.j.cn114452-20201120-00846
摘要
液相色谱-串联质谱法(LC-MS/MS)是临床生化小分子检测的首选方法,常用于血清25-羟维生素D[25(OH)D]的检测。其虽有高灵敏度、高特异性、线性范围宽等优势,但因仪器、色谱柱、试剂、校准物、方法学及性能验证等因素的影响,也会造成同一个实验室内部及不同实验室之间的LC-MS/MS检测结果存在较大偏差。标准化是确保在不同实验室、不同质谱仪器及不同时间,获得一致性和可比性结果的必要条件。为规范LC-MS/MS检测25(OH)D的方法,该共识基于目前现有的临床质谱相关指导文件和临床实践,针对同位素稀释LC-MS/MS的标准物质和内标物选择、方法验证、色谱质谱参数选择、质量控制、人员要求及参考区间等方面提出建议,旨在提高检验结果的准确性及可靠性。
维生素D与人体骨骼发育、自身免疫力、心血管健康等方面息息相关,维生素D缺乏、代谢异常或过量均会对健康产生较大影响,因此检验结果的准确性对于临床评估机体基础水平、制定干预方案等方面至关重要。
目前血清维生素D检测方法主要为化学发光免疫分析法(chemiluminescent immunoassay,CLIA)和液相色谱-串联质谱法(liquid chromatography- tandem mass spectrometry,LC-MS/MS)。从检测原理出发,LC-MS/MS是基于被测生物标志物本身分子量、结构等化学性质的直接分析法,因此具有独特高灵敏度、高特异性和高通量特点[1]。CLIA是基于抗原抗体反应,与LC-MS/MS相较,前处理简单且检测自动化程度高,但存在特异性低、线性范围窄和检测结果可比性差等问题。
LC-MS/MS首次运用于常规临床实验室时,其结果通常被认为准确可靠。然而目前LC-MS/MS检测25-羟维生素D[25(OH)D]的方法大多为实验室自建方法,虽然已有多类质谱检测试剂盒陆续上市,但方法缺乏标准化,无法避免因受仪器、色谱柱、试剂、校准物、方法性能验证等因素而导致检测结果差异很大[2]。另外,方法验证指南的不适当解读和应用、标准物质的缺乏或不适当使用、质量保证措施的不完整均可导致检测结果的偏差甚至错误。
LC-MS/MS检测血清25(OH)D方法的标准化是其在临床实验室成功应用的必要条件,也是保证方法之间一致性和可比性的核心要素。本标准化涉及量值溯源、检测的特异度和精密度以及样本的前处理等过程,其中量值溯源可确保常规实验室检测结果溯源至国内或国际公认的参考测量系统[3],保证检测结果的准确性。其检测特异性能避免血清中的其他物质和基质的干扰,而好的精密度是保证实验室检测稳定性和重现性的必要条件。实验室目前可获得技术指导文件包括CLSI-C62A[4]、《液相色谱-质谱临床应用建议》[5]、《液相色谱串联质谱临床检测方法的开发与验证》[6]等。基于此,本专家共识旨在建立标准化的血清25(OH)D检测方法,从标准物质和内标物的选择、仪器与试剂的准备、检测方法注意事项、质量控制管理、人员要求及参考区间等方面提出建议。
一、术语及定义
1. 25(OH)D:人体血液中维生素D的主要循环形式包括25(OH)D2和25(OH)D3,其中25(OH)D3为主要存在形式,因其稳定性好,可作为评价人体维生素D水平的可靠指标。
2. 内标:加入到待测样品中,作为测定待测组分含量的参照标准及其已知质量或含量纯物质。
3. 标准物质:具有足够均匀且稳定的特定特性物质,其特性适用于测量及标称特性检查的用途。
4. 有证标准物质:附有由权威机构发布文件,提供使用有效程序获得且具有不确定度和溯源性的一个或多个特性值标准物质。
5. 定量下限(limit of quantitation, LOQ):在规定的测量条件下,以指定的测量不确定度能测量的样品中可被测量的最低值。
二、维生素D主要生理功能及代谢路径
人体维生素D缺乏、代谢异常或过量均会影响肠道钙、磷吸收和骨代谢[7]。此外,维生素D与心血管细胞上的维生素D受体结合,低水平状态时,机体可通过激活促炎症瀑布导致内皮功能异常和动脉壁的硬度增加而加重心血管疾病的危险性[8]。维生素D受体亦存在于免疫系统的细胞中[9],通过与受体结合可降低细胞因子(炎症蛋白质)水平,并且增加抗菌肽的含量,已有研究表明,充足的维生素D水平可预防呼吸道感染[10]。由于维生素D是一种脂溶性维生素,易储存于体内(主要肝脏),过量时可产生不良反应。因此,精准的检测结果可帮助临床准确评估人体维生素D营养状态、吸收障碍或毒性水平。
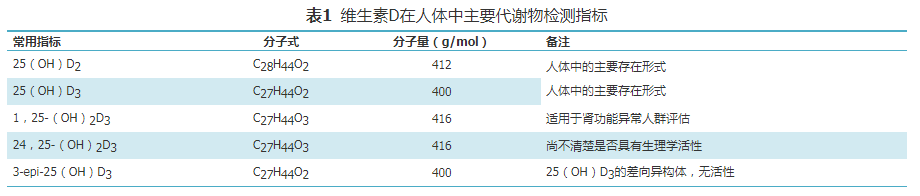
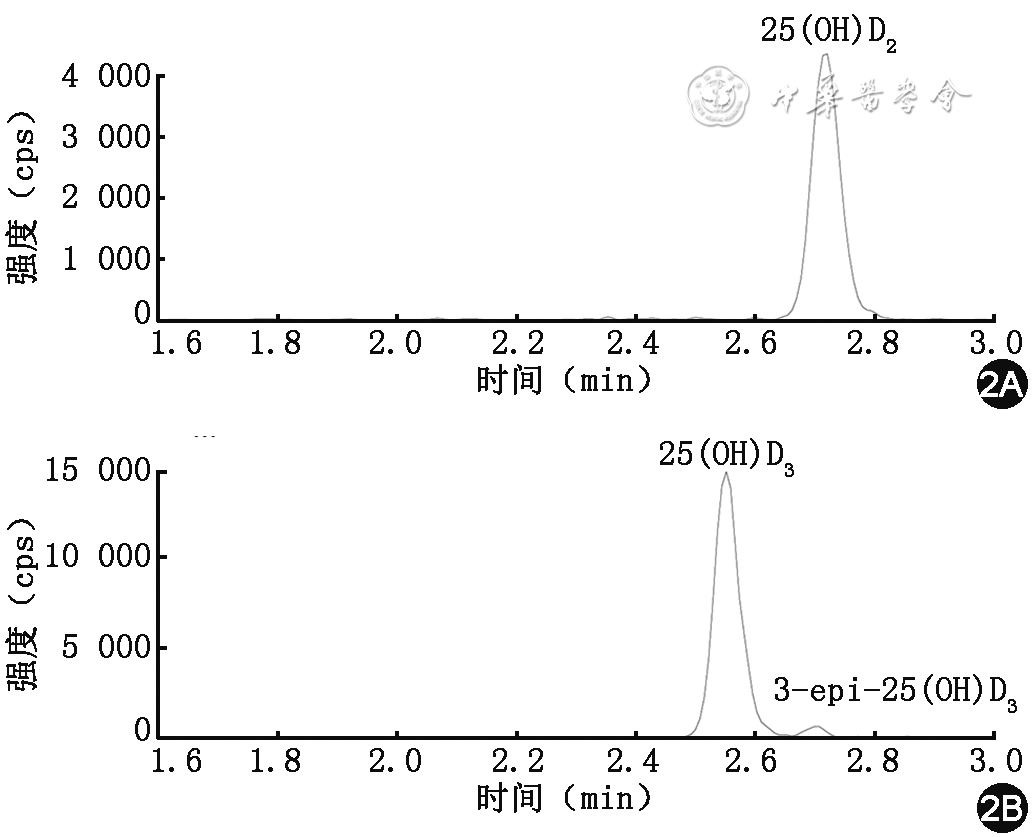
人体维生素D主要来源于皮肤经阳光作用合成的维生素D3,另一种来源是食物中(如经光照后的蘑菇、野生海鱼等)的维生素D2[11],两者通过肝脏代谢后以2种形式存在,分别是25(OH)D2和25(OH)D3,虽然人体血液中超过95%的25(OH)D为25(OH)D3,但仍存在少量25(OH)D2,若补充外源性25(OH)D2,则体内可检测出浓度较高的25(OH)D2,因此需分别对25(OH)D2和25(OH)D3进行定量检测。25(OH)D在肾脏和其他组织中转变为具有生物活性的二羟基代谢物1,25-羟基维生素D[1,25-(OH)2D],该物质经过维生素D结合蛋白转运至靶器官,与维生素D受体结合,从而发挥其生理作用(图1)。1,25-(OH)2D在人体内的浓度低(pg/ml级别)、半衰期短,检测难度较大,而25(OH)D因其浓度高、稳定、半衰期较长,是反映机体维生素D代谢的重要检测指标。此外,25(OH)D3与3-epi-25-羟基维生素D3[3-epi-25(OH)D3]为同分异构体,其质荷比一致而导致无法通过质谱直接分离,一般可通过色谱分离的方式使这2种分析物具有不同保留时间;当分离度达到1.5时,可忽略3-epi-25(OH)D3对25(OH)D3检测的影响。在学龄儿童体内,3-epi-25(OH)D3占25(OH)D的2.5%~17%[12],但在出生后前3个月婴儿体内,3-epi-25(OH)D3浓度较高,占25(OH)D浓度的60%,在成人中占比较低,偶尔可高达22%[13]。具体指标见表1。
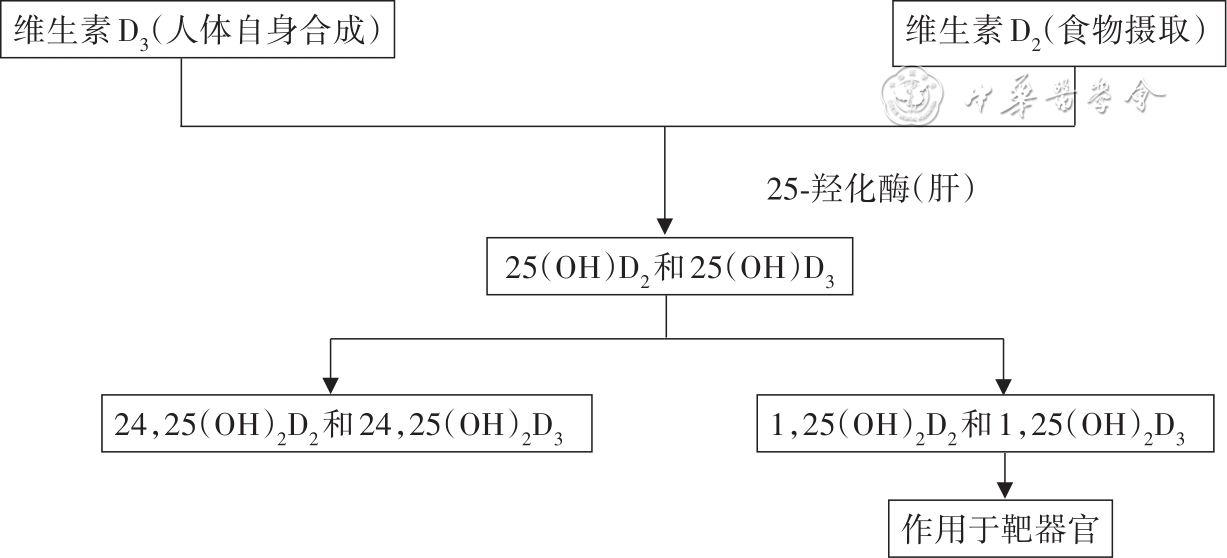
图1 维生素D代谢途径
三、LC-MS/MS技术
LC-MS/MS是通过质量分析器测定带电粒子质荷比的一种分析技术;MS/MS是将2个质量分析器由碰撞室串接起来的分析设备,即三重四极杆质谱仪。第一级质量分析器筛选出被离子化的样本中特定质荷比的母离子,母离子进入碰撞室,通过碰撞诱导解离的方式形成碎片子离子;第二级质量分析器筛选出特异性强的定量子离子及定性子离子,子离子进入检测器监测,最终得到目标分析物的含量。每个母离子/子离子对被称为1个离子对,只有具有特定离子对的待测物质,才能进入检测器。因此,MS/MS具有很好的检测特异性。此外,质谱方法具有同时监测多离子通道多反应监测(multiple reaction monitoring,MRM)的独特优势,即使在检测背景信号高的内源性化合物时,亦可通过同时监测2个离子碎片通道,实现待测物质的精准检测。
(一)标准物质的选择
维生素D检测的标准化包括众多因素,其中具有溯源性的有证标准物质是实现量值溯源、检测结果准确一致的重要保证。目前国内外研制25(OH)D有证标准物质的国家级权威机构有中国计量科学研究院、美国国家标准和技术研究院,若不可获得相关权威机构或国际公认的有证标准物质,则其他获得相关国家认可委员会标准物质生产者认可的提供明确溯源途径和测量不确定度的标准物质可作为替代选择,如美国Sigma-Aldrich公司旗下子公司Cerilliant等提供的25(OH)D标准物质可作为替代选择,具体信息见表2。
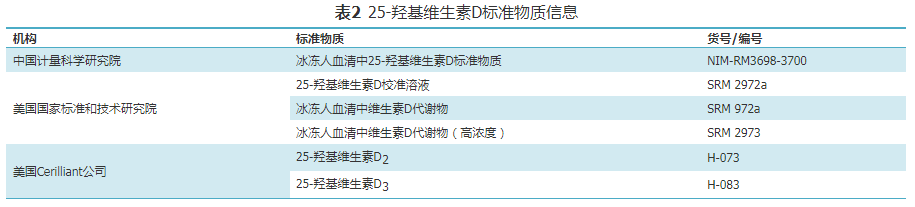
实验室在可能的情况下,应溯源到国家或国际较高级别标准物质;若不可获得,可以溯源至低一级别标准物质或厂家提供的标准物质。临床检验实验室如采用已上市25(OH)D试剂盒(二类),其校准物的靶值见相应批次产品的赋值证书。适用时,厂家校准物的值应溯源至较高计量学等级的标准物质或参考方法。标准物质接收/验收质控要求:请标准物质生产者/经销商提供运输过程质控措施(常用措施为试剂条或者电子温度计),当运输过程未达到要求时,不予接收使用。
(二)内标物的选择
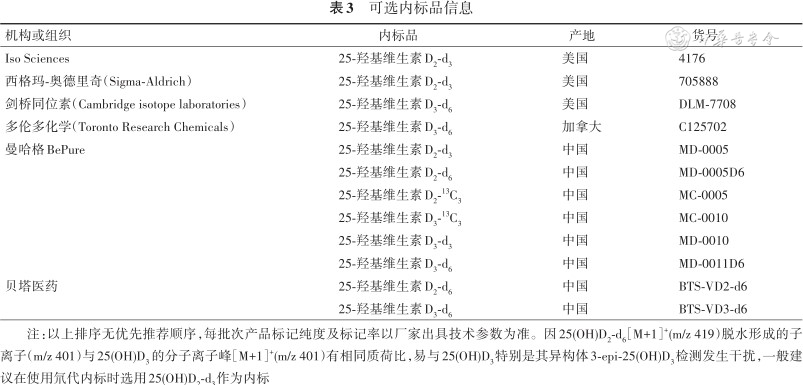
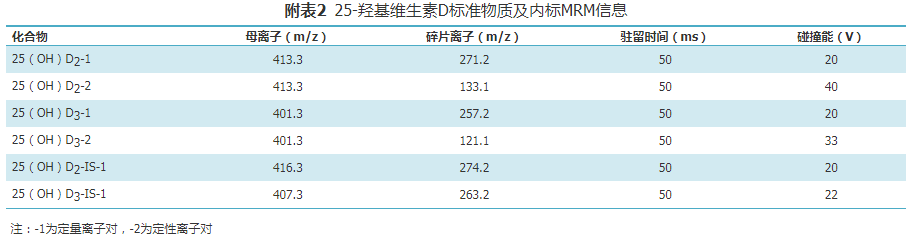
LC-MS/MS分析过程中的内标物可用于校正基质效应以及样本前处理、色谱分离和离子化过程引入的偏差,有助于提高定量分析的准确度和精密度。推荐使用25(OH)D的稳定同位素标记物作为内标品,一般有2种:氘代内标或13C同位素内标。要求内标物的分子量至少比目标分析物大3个分子量。内标物化学纯度≥98%,同位素标记纯度≥97%,如果低于该要求纯度,则其未标记的化合物浓度会与25(OH)D2或25(OH)D3的检测下限接近,导致检测结果系统性偏高。因此,必要时应对内标物的纯度进行测试,以避免其中含有与目标分析物共洗脱且具有相同质量数的干扰物质。内标优选同位素标记纯度高且价格合理的产品。目前可选的内标物见表3。
目前临床常见的样本前处理方法包括:蛋白沉淀法、液液萃取法、固液萃取(solid liquid extraction, SLE)、固相萃取法(solid phase extraction, SPE)和免疫富集等。生物样本分析的主要障碍包括浓度低、干扰大、个体差异大等,样品处理目的主要是去除样品中的杂质,富集样品。针对血清25(OH)D的检测,如果仪器灵敏度高,蛋白沉淀法可作为首选的样品处理方法,具有耗时少,简单、经济等优点,但需要进行适当的色谱分离,以减少基质效应。SLE和SPE虽然可以去除样品的基质及富集样品,但其洗脱效率容易受到洗脱耗材的批次间差异的影响,需要进行不同厂家及不同批次间的比对。
(四)色谱条件选择
色谱柱、流动相和保留时间都是影响检测结果准确性的关键因素。色谱柱的选择可参考厂家提供的特性参数和文献报道综合考虑,在其应用寿命期限内,应关注保留时间、峰型、分离度变化等参数,及时进行色谱柱的保养和更换。在此基础上,根据被测化合物的特性,进行流动相的优化,尽量避免使用非挥发性盐、无机酸、表面活性剂等流动相添加剂,尽量不用或少用极低浓度(<0.02%)的流动相添加剂如果需要进行3-epi-25(OH)D3的分离,则需确保色谱条件可以实现其与25(OH)D3的基线分离,参考谱图见图2。
(五)质谱参数选择
质谱仪器参数主要包括离子源参数,离子对的选择及其扫描参数。LC-MS/MS定量分析推荐一个分析物使用2个离子通道,分别作为定量离子通道和定性离子通道。25(OH)D2和25(OH)D3是水解代谢产物,热不稳定及离子化过程中也容易形成脱水子离子。需要注意的是其在基质中的背景噪音偏高,应避免选择脱水的子离子碎片(即母离子减少18的碎片离子)。但如果大气压化学电离源作为离子化模式,其在离子源中完全脱水形成稳定的脱水离子可以作为母离子。在任何给定时间内监测到的离子对通道越多,单个色谱峰可采集到的数据点就越少,如果用于表征色谱峰面积的数据点数量不足,数据的可靠性可能会受到影响,扫描时间单个色谱峰包含至少10个(建议15~20个)数据点。此外,优化离子通道内延迟时间,以避免碎片离子间发生交叉干扰[5]。初步确定碰撞池电压和碰撞池能量后,建议使用提取样本进样以获得基质样本中最佳信噪比的碎片离子。
(六)方法验证:在采用LC-MS/MS实验方法开展25(OH)D临床检验前,必须先对采用的检测方法进行性能验证,通过后方可用于临床样本的检测。验证内容包括检测限、定量上下限、线性、精密度、正确度、基质效应及加样回收和样品稳定性等,具体要求可参考相关文献如《液相色谱-质谱临床应用建议》[5]、《液相色谱串联质谱临床检测方法的开发与验证》[6]等。
蛋白沉淀/固液萃取法:以25(OH)D2-同位素标记[25(OH)D2-IS]和25(OH)D3-同位素标记[25(OH) D3-IS]为内标,采用LC-MS/MS检测经有机试剂提取的样本(包括标准物质、质控物和待测血清样本)中25(OH)D2和25(OH)D3,并通过液相保留时间和质谱离子对的不同实现其与干扰物的分离。
1. LC-MS/MS联用系统(具有医疗器械注册证)应满足以下适用条件:(1)高效液相色谱仪;(2)三重四极杆串联质谱仪;(3)具有二类医疗器械认证的数据分析软件。
2. 液相色谱柱:应满足以下适用条件:(1)PFP(五氟苯基)或C18色谱柱,具有良好的稳定性和重现性;(2)满足规格内径和理论塔板数使用要求即可。
3. 其他设备:(1)96孔板振荡器:振荡转速范围中包含600 r/min。(2)微量移液枪:规格为10~200 μl的微量移液器,应校准合格。(3)96孔板离心机:水平转头离心机,转速不得<4 000 r/min,以减少上机样本的蛋白杂质。(4)96孔过滤板:亲水性聚四氟乙烯滤膜(PTFE),滤膜孔径≤0.45 μm,体积≥0.5 ml,适用于蛋白沉淀法。(5)96孔SLE板:填料采用高比表面积的多孔硅藻土,需要保证批次间的均一性和稳定性。96孔接收板:体积≥0.3 ml。(6)微孔板封片:硅胶盖板或铝箔封片。
4. 试剂与配制:(1)二类25-羟维生素D检测试剂盒:可溯源至可获得的最高级别标准物质。(2)标准曲线:建议25(OH)D2的标准曲线范围至少包含2~100 ng/ml区间,25(OH)D3的标准曲线范围至少包含5~250 ng/ml区间,并且在选定的标准曲线范围内一般分散设置4~5个浓度点。配制过程中应制成不同浓度的标准品工作液,必要时,稀释过程应避免从同一浓度的标准品工作液进行逐级稀释产生的系统误差,应选用2个不同浓度的工作液进行稀释后组成同一条标准曲线。(3)质控样本:质控样本的初级工作液应单独配制,避免和标准曲线使用同一工作液。无论商品化或自配质控样本,其基质应尽量和患者样本基质保持一致,以减小样本处理和离子化中的基质效应。建议配制2~3个浓度质控样本,浓度范围建议在临床参考区间的基础上(分布于正常和异常参考区间),结合分析方法的标准曲线综合设定,通常为标准曲线中3倍左右的LOQ、中间浓度±20%和70%~80%的定量上限,以确保不同浓度未知样本的准确性。同时,每批次样本检测前、后均运行质控样本。(4)甲醇:质谱纯。(5)甲酸:质谱纯。(6)去离子水:除另有特殊说明,应使用《GB-T 6682-2008 分析实验室用水规格和试验方法》[14]定义的一级实验用水。(7)流动相A:建议采用甲酸水(1∶1 000)溶液,或根据试剂说明书配制。(8)流动相B:建议采用甲酸甲醇(1∶1 000)溶液,或根据试剂说明书配制。
本方法适用于新鲜、冷冻或冻干血清样本的25(OH)D2和25(OH)D3浓度检测。在处理样本时,应严格遵从生物安全规则,针对可挥发性或轻微毒性的有机物质,实验操作人员应有基本的防护(实验服、防护手套和防护眼镜),实验操作宜在通风橱或生物安全柜中进行,避免皮肤接触试剂,一旦接触,请立即用清水冲洗。
样本的保存和运输可参照《WS-T 225-2018 临床化学检验血液标本的收集与处理规范》[15]进行静脉血采集、血清分离和血样的保存。采集后的血清样本若不能及时检测,应避光保存,在室温下可保存1 d,2~8 ℃下可保存7 d,-20 ℃可保存12个月,-80 ℃可保存14个月。
样本运输过程中宜使用冷藏包或同类物品,样本应置于冷藏包中间,空余位置用塑料泡沫填充,样本冷藏包内放置的冰袋不应直接接触样本。样本应在指定时间内到达,如因客观原因延迟,应及时补充冰袋等冷藏剂。运输过程应避免阳光照射。样本接收时应同时获得实时温度记录单。
蛋白沉淀参考方法:取25 μl蛋白沉淀剂于96孔过滤板中,依次加入200 μl内标液和100 μl样品血清样品后,置于96孔板振荡器中,600 r/min涡旋10 min;在96孔过滤板下方放置96孔接收板,4 000 r/min离心5 min;取下96孔接收板,封板后待LC-MS/MS检测。或参考其他试剂说明书。
固液萃取法:参考技术标准《WS/T 677-2020人群维生素D缺乏筛查方法》[16]。
样本上机前应对液相色谱串联质谱系统进行准备,包括:(1)色谱柱平衡:色谱柱类型及填料量的不同,所需平衡时间也不同,通常为10倍色谱柱体积的流动相[17]。可采用流动相梯度洗脱程序的初始浓度冲洗色谱柱至柱压稳定。(2)系统适用性:仪器达到平衡状态之后,至少分析3次系统适用性溶液(SST),该系统适用性溶液可采用25(OH)D试剂盒中提供的SST或者内标溶液,一般浓度为50~100 ng/ml。3次进样结果中目标分析物保留时间的偏差应在±0.2 min范围内,内标峰面积与仪器正常状态的累积靶值偏差应在±20%以内,且3次进样变异系数(CV)≤15.0%。测试失败可能表明仪器系统性能存在问题,应进行检查。
(六)分析方法
请查看附件检测方法示例:血清25-羟基维生素D检测方法(LC-MS/MS)。
1. 人员保证:应符合《GB/T 22576.1-2018/ISO 15189∶2012》中人员部分的规定,包括合适的人员资质、清晰的岗位描述、不同岗位的培训/评估及专业发展等。
2. 人员培训:应为所有人员提供包括:质量管理体系、具体分派工作程序、适用的实验室信息系统、健康与安全(包括职业病危害、生物安全、防止或控制不良事件的影响等)、伦理、医院感染、患者信息保密等;同时也应提供质谱仪相关的使用维护培训。
由于实验室可能会使用不同的仪器、试剂、色谱柱,或者人员变化等都可能导致检测系统的变化,只有对整个环节做好质量控制,并形成完善的质量管理体系才能更好地保证检验结果的准确性和可比性。实验室除了做好人员培训及能力评估、样品管理、试剂管理、仪器管理等方面,同时应使用质控对检测环节进行监控。
1. 室内质量控制:为监测检测系统的稳定可靠性,判断每批临床样品检测结果的可信度,实验室应按照《WS/T 641-2018临床检验定量测定室内质量控制标准》[18]实施室内质量控制。(1)质控物的选择:推荐使用25(OH)D试剂盒配套质控物。若实验室自配质控物,则应做好相关配制记录,评估均匀性、稳定性以及安全性。(2)浓度水平:至少使用2个浓度水平的质控物,且其浓度应位于临床有意义的浓度范围内。使用说明书上的原靶值仅做参考,实验室应重新累积靶值。(3)质控频率:参照《WS/T 641-2018 临床检验定量测定室内质量控制指南》[18],在每个分析批内至少对质控品检测2次。(4)质控规则:参照《WS/T 641-2018临床检验定量测定室内质量控制指南》[18],至少采用2个质控规则,以检出随机误差和系统误差。(5)接受标准:根据国家卫生健康委临床检验中心(NCCL)组织的内分泌室间质量评价(NCCL-C-07)中25(OH)D的评价限为±25%,因此实验室可将25%作为总允许误差(TEa),同时建议日常使用中25(OH)D的质控品CV控制在8.3%(1/3 TEa)以内。
2. 室间质评:为确保实验室间25(OH)D2和25(OH)D3的结果可比性,实验室应按照《WS/T 644-2018 临床检验室间质量评价》[19]的要求,每年向省级或省级以上室间质量评价计划组织者申请参加室间质评计划,如果可行,可参加正确度验证计划;同样也可以参加国内或国外具有室间质评资质的机构开展的质评计划来评估实验室检测结果的准确性。实验室可将参加正确度验证计划的结果进行分析,绘制室内精密度和正确度图,持续监测和改进方法的性能。
实验室的质评结果应满足组织机构的评价标准。当实验室出现不合格结果时可以借助《WS/T 414-2013 室间质量评价结果应用指南》[20],彻底调查每个不合格结果,包括错误问题的根源调查、排除问题根源的纠正措施、对纠正措施的监控和验证、评估日常样本检测结果是否受到影响等。同时,实验室应监控室间质评结果的趋势,关注是否连续多次分布于平均值的一侧或多次室间质评的结果不精密度持续增加等现象。若出现类似情况应及时采取措施以避免出现进一步不合格结果或患者检测结果不准确的情况。
3. 其他质量控制指标:由于质谱仪的特殊性,实验室除了关注每日质控和室间质评外,同样还需关注质谱其他可能涉及的指标。此外,应定期进行正确性质量控制的验证,如测定有证标准物质SRM972a、参加25(OH)D正确度验证计划等,以持续监测方法的正确度。(1)双空白:即不加内标、不加待测物标样的样品。血清基质较为复杂,容易在仪器上发生基质残留,因此建议在系统适用性符合的情况下检测双空白溶液,在对应分析物的出峰时间处若无干扰,则可继续进行下一步的检测。(2)单空白:即加内标、不加待测物标样的样品。质谱法测定维生素D往往采用内标法定量,因此建议同时关注单空白。在对应25(OH)D2、25(OH)D3的出峰时间处无干扰,则可确定在用内标是稳定的。(3)标准曲线:建议每批检测样品中都同步进行标准曲线的检测,并监测标准曲线相关标准,如r2及各浓度点是否符合r2≥0.99、LLOQ准确度为80%~120%,其余浓度点为85%~115%的要求[10]。若需要减少定标频率,则应首先考察不同定标频率下的质量控制情况,确保整体质量符合要求的前提下,方可实施。(4)内标稳定性:内标是质谱法定量环节中非常关键的一个步骤。每个批次在定量计算前需要分析这些样本中的内标响应是否稳定,比如内标峰面积的CV<20%是否符合。(5)充足率:维生素D作为内源性的指标,其在体内的充足率目前报道较多。我们在进行结果审核时可以根据文献报告或者实验室长期监测的比率,来监控实验室每天的数据整体分布是否合理。
综上所述,LC-MS/MS是临床小分子标志物检测的强有力的工具,维生素D对人体有重要的生理病理学意义,如要实现其方法学的标准化,还需从色谱柱、试剂、校准物、色谱/质谱参数等多个方面进行规范,方可获得高质量、高准确度并具临床价值的检验结果,从而实现不同实验室间检测结果的可比性和互通性。质谱技术人员需充分理解及运用好LC-MS/MS工具,助推精准诊断在临床的发展运用。
执笔人:刘华芬(杭州医学院检验医学院),毛远丽(解放军总医院第五医学中心检验科),徐蓓(中国计量科学研究院化学所)
专家组成员(按姓氏拼音排序):龚美亮(解放军总医院第五医学中心检验科),郭健(北京医院),黄宪章(广东省中医院检验医学部检验科),李水军(上海市徐汇区中心医院检验科),刘辉宇(安徽工业大学生物化学系药学院),邱玲(中国医学科学院 北京协和医院检验科),石莲花(中国计量科学研究院化学所),张传宝(北京医院 国家卫生健康委临床检验中心),张江涛(北京医院 国家卫生健康委临床检验中心),周伟燕(北京医院 国家卫生健康委临床检验中心),周永列(浙江省人民医院检验科),邹迎曙(北京市医疗器械检验所 体外诊断检验室)
所有作者均声明不存在利益冲突
附件 血清25-羟基维生素D液相色谱-串联质谱检测方法示例
一、标准溶液、质控样品和内标溶液的准备
1.标准曲线和质控样品的准备:在室温下精确量取150 μl超纯水到标准物质或质控物试剂瓶中,漩涡混匀至冻干粉完全溶解后备用(如瓶塞上存在粉末,请加塞后上下颠倒数次至冻干粉溶解),瓶塞不得混用。标准物质和质控物的靶值见相应批次产品的赋值证书。
2.内标溶液的准备:取试剂盒中内标液,在室温下复温5 min,开瓶直接使用。
3.样本前处理:(1)精密移取25 μl的蛋白沉淀剂于96孔过滤板中;(2)精密加入200 μl内标液;(3)精密加入100 μl样品(标准曲线样品、质控样本、血清样本);(4)置于96孔板振荡器,以600 r/min涡旋10 min;(5)在96孔过滤板下方放置96孔接收板,在4 000 r/min离心5 min;(6)取下96孔接收板,封板后使用液相色谱串联质谱仪方法进行检测。
二、色谱/质谱条件
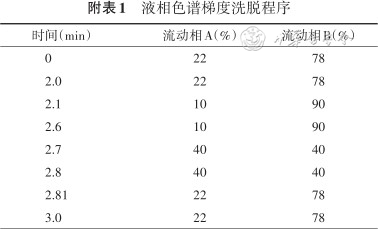
1. 液相色谱洗脱条件:以2.6 μm,3.0×100 mm PFP(全氟苯基)色谱柱为例,使用者可根据实验室需要进行条件优化(附表1)。
2. 质谱条件:使用者可以有效提高检测灵敏度为目标,优化离子源参数和化合物参数。可采用针泵连续进样的方式,手动建立或自动优化多反应监测(MRM)定量分析的质谱参数。质谱的电离方式、离子源温度、去簇电压、碰撞能对分析物的响应强度影响较大,需对这些参数分别寻优,使化合物的信号灵敏度最高,且稳定性良好,可参考附表2。
电离方式:大气压化学电离或电喷雾电离源模式,正离子。
检测方式:MRM扫描方式,母离子定量离子、定性离子和碰撞能量等参数见附表2。可根据实际需要进行调整。
三、样品检测
1. 系统适用性测试:取系统适用性溶液,至少连续进样3针,3次进样结果中25(OH)D2和25(OH)D3的保留时间的偏差应在±0.2 min范围内,25(OH)D2和25(OH)D3与其内标的峰面积比值的CV应≤15%。如系统适用性溶液测试结果不满足上述要求,可重复进样3针。
2. 样品检测:取处理好的校准品、质控品和血清样本注入高效液相色谱-串联质谱仪进行检测,记录色谱图与待测样品中25(OH)D2、25(OH)D3的峰面积和对应内标峰面积。
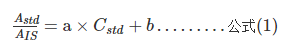
公式(1)中:Astd 为标准曲线样品中25(OH)D2或25(OH)D3定量离子MRM峰面积;AIS 为标准曲线样品中内标物MRM峰面积;Cstd 为标准物质的标示浓度;a为斜率;b为截距。
2. 浓度计算:根据工作曲线计算血清样本中25(OH)D2、25(OH)D3和25(OH)D的含量。值得注意的是,封板后的样品在2~8 ℃条件下可稳定保存2 d。
五、参考区间
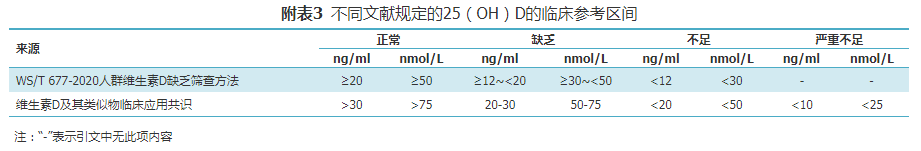
根据《WS/T 402-2012临床实验室检验项目参考区间的制定》规范,实验室可在本地建立参考区间,或者引用有完整溯源链的试剂厂家提供的参考区间进行小样本验证,每个参考区间至少选择20份样本,1个样本可以偏离已知参考区间。此外,目前可供参考的临床参考区间如附表3所示。
根据《GB/T 22576.1-2018/ISO 15189:2012》中的“结果发布”部分进行检测结果的报告发布,报告前可综合评估以下因素:质控是否在控,与此前结果是否一致,样本质量等因素进行综合考量。此外,建议各实验室报告单上分别显示25(OH)D2、25(OH)D3和25(OH)D的含量。














