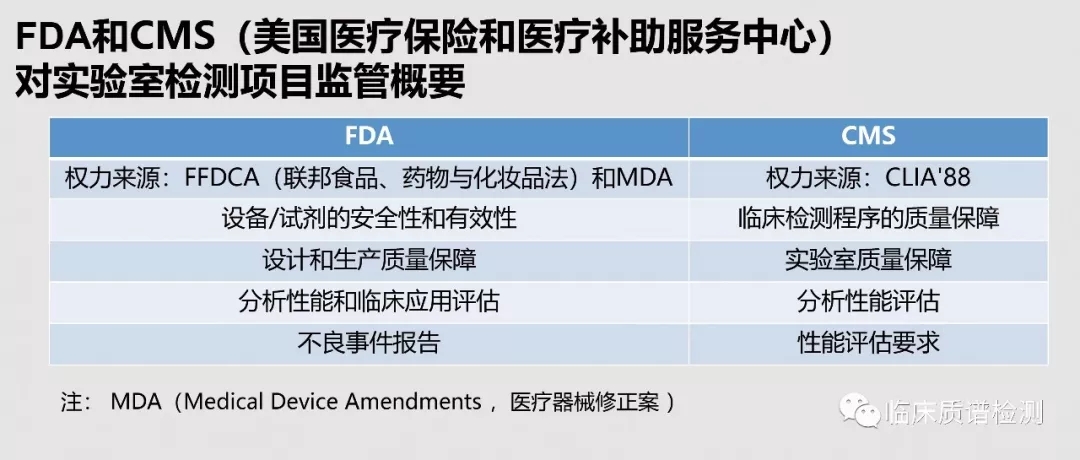
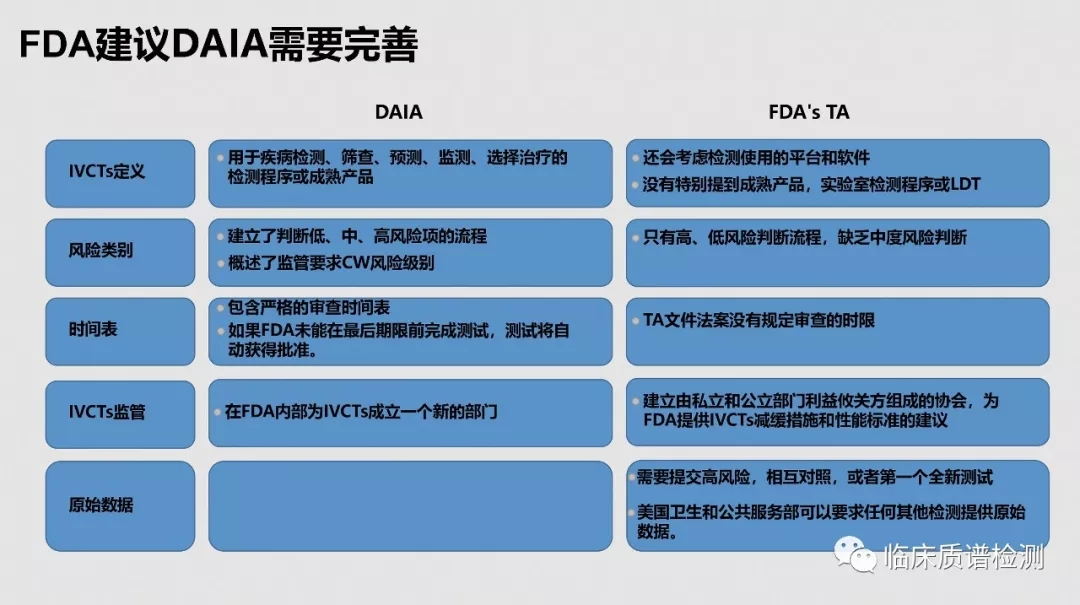
导语:在美国,医学实验室自建检测项目(Laboratory-Developed Tests ,LDTs)发展已有数十年,最初FDA认为当时的LDT是简单和低风险的,将之归入Ⅰ类体外诊断产品范畴。Ⅰ类风险程度较低,只需医疗保险和医疗补助服务中心(The Center for Medicare & Medicaid service,CMS)依据CLIA对临床实验室和科研实验室监管。这种区别于IVDs的监管模式极大的促进了LDTs的发展,但是在其飞速发展的同时也造成了许多方面的问题。为了大家能更好的了解美国LDTs的现状和相关政策,本平台特别整理和翻译了梅奥医学实验室医学总监、血液病理学部高级助理顾问Mohamed Salama, M.D在首届药明奥测精准医学高峰论坛上带来的题为“美国医学实验室自建检测项目和相关的联邦政策”精彩讲解的PPT。

Mohamed Salama, M.D. 梅奥医学实验室 医学总监 血液病理学部 高级助理顾问