5.5 具有国际一致性的方案的情况;没有国际约定的校准品或约定的参考检测程序;没有较高等级的参考物质或参考检测程序,没有计量溯源性至SI(图5)
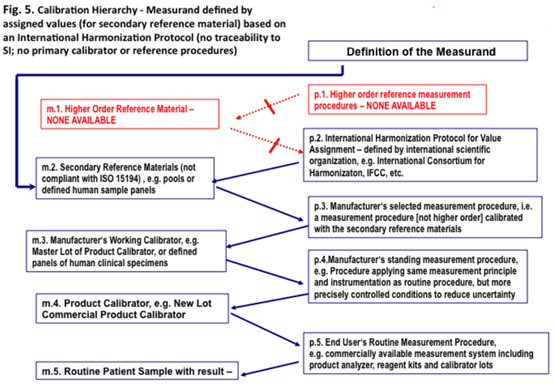
图5、校准层次- 依据一个国际一致性方案被确定值确定的被测量(作为二级参考物质)(没有溯源性至SI;没有一级校准品或参考程序)
5.5.1 在图5中描述的校准层次应适用到人样品中被检测的分析物的可检测量,该分析物没有国际一致的参考检测程序;没有一级参考物质,没有约定的参考检测程序,一级没有溯源性至SI。在可用的常规检测程序间的国际一致性方案建立的校准。
5.5.2 对一组人临床样品(m.2)检测的量,被用于建立一个校准层次,预期去实现在可用的常规检测程序(p.5)间报告的结果等同。
注1:每一个人临床样品内的被测量,被假设代表了某个给定的临床用途情况需要的被测量。但是,在不同的临床样品间会呈现了多个形式的被测量。
注2:在一个给定的临床用途情况需求的被测量,会没有被完整地理解和描述。
注3:检测程序(p.3,p.4,p.5)会对于给定的临床用途情况需求的被测量是不特异的。
注4:对一组临床样品的被测量和基质稳定性的储存条件的限制,必须被包括在方案中。
注5:被应用在这个溯源性计划中作为校准品的人临床样品的选择指标,应明确地确定和规定。
5.5.3 一个国际上一致的方案(p.2)被用于对(一组)人临床样品(m.2)设定量值。
注1:方案的一个示例是为每个成员的组合临床样品应用了一组常规检测程序(经典地包括了符合按照图5的方块p.5确定的检测程序),被认定资格具有合适的性能特性去检测量的,为每个成员的组合临床样品(m.2)(在去除离群值后)确定均值。
注2:确定适当的性能特性通常依据对一组人原始样品的检测结果,应包括颗粒:不精密度、特异性、和相关,连同其他关键性能特性。
注3:某些终点用户的常规检测程序由厂商提供(p.5)的,会没有合适的性能特性,可包括在一致性/值设定方案(m.2),参与检测一组人临床样品或二级参考物质。这样的常规检测程序(p.5)应不包括在第5.5章中一致性方案,直至检测程序被改善去纠正被证实的性能局限性。
5.5.4 设定值和一致性的方案,应包括持续一致性方案的程序,即通过创建人临床样品的替代组,被用于作为(m.2)二级参考物质。
注1:每个组合应含有独特的人临床样品。在不同组和内的样品在被测量形式、基质和影响的量上会不同。
注2:应提供选择临床样品的说明书,以优化替代的组合将具有与被测量检查有关一致的特性的可能性。
注3:应提供预期协助确保为选择替代组合(m.2)值设定过程的一致性。示例:第一组合(m.2)的临床样品一个亚组,可用于转换设定到以后的组合。
5.5.5 人原始样品组的互换性,应被假设是可接受的,因为临床样品是使用常规检测程序检测(p.5)的预期样品类型。
5.5.5.1 对人原始样品互换性的推测,必须被来自收集各个样品的收集和处理样品、包括分样和储存、以及为样品的分布、制备和使用的条件的资格的方案支持。
注:在厂商选定的(p.3)或常设的(p.4)检测程序或在常规检测程序(p.5)中的局限性,特别对被测量的非特异性、或对非被测量影响量的灵敏度,会引起不同常规检测程序间的结果的差异,潜在地导致关于组合(m.2)互换性的不完整的结论。为此,很重要的是设定值的方案,包括检测程序适用性资格,如第5.5.3节内注1所示。
5.5.5.2 为确认互换性评估方案和使用的统计的数据和报告,应是可用的。
5.5.6 一组人的临床样品(m.2),不可溯源到SI单位的,应被用于校准厂商选定的检测程序(p.3),不是参考检测程序。
注:厂商选定的检测程序会与厂商的常设检测程序(p.4)或常规检测程序(p.5)相同,但在较精确地控制统计下操作,以减少被检测量的不确定度。
5.5.7 厂商选定的检测程序(p.3)应确定某个检测系统,以使用一组人临床样品(m.2)的方案校准。选定的检测程序,在被相应校准时,应被用于为厂商工作校准品(m.3)确定设定值。
5.5.8 厂商工作校准品(m.3)应按照厂商选定的检测程序(p.3)设定值。这个校准品有时被称为“厂商一级(master)校准品”(或“内部标准品”)。厂商的工作校准品(m.3)应已经展现了与厂商的选定检测程序(p.3)和厂商的常设检测程序(p.4)的互换性。
注1:一个厂商的工作校准品可以是,如,具有基质的物质,相似于被终点用户的常规检测程序检测的人原始样品。
注2:厂商的工作校准品可以是一组人临床样品。
5.5.9 厂商的常设检测程序(p.4)应确定一个检测程序,被一个或多个厂商的工作校准品(m.3)或较高类型的校准品,如一组人临床样品(m.2)校准,并被确认了分析特异性。
注1:厂商常设检测程序会与常规检测程序(p.5)相同,或依据相同的原理和检测方法,但在较精确的控制统计下实施,以减少检测量的的不确定度。
5.5.10 厂商产品校准品(m.4)应由厂商的常设检测程序设定值,和被预期去校准临床实验室使用的常规检测程序(p.5)。
注1:厂商的产品校准品可以是,如具有基质的物质,类似于终点用户的常规检测程序检测的人原始样品。
注2:厂商的产品校准品会与人原始样品是不可互换的,在这个情况下可以设定一个程序特定的校正因子,去校正不可互换性的大小,使得对病人样品检测值,按照设定值的方案(p.2),可溯源至到一组人临床样品(m.2)。
5.5.11 临床实验室(p.5)使用的常规检测程序,应叙述为一个检测系统,经常由厂商供应,以一个或多个厂商校准品校准。
5.5.12 在消除了某个校准层次(一个校准品和一个程序对)的水平下,可以减少不确定度。见第5.1.3节的限定。
我对这个溯源性链的认识
在国际度量衡局、IFCC、和国际实验室认可合作组织合作下,2002年建立了检验医学溯源性联合委员会(JCTLM)。JCTLM保持提供CRM、RMP、和符合ISO要求的参考实验室数据库。MP的厂商可使用JCTLM列出的资源,确保校准溯源性等级,但它们的使用将依从EU导则。一个RMP和一个CRM重要的属性是,它们可以在任何时间和任何地点再现,预期可使用在一个校准溯源性等级。
标准化一词传统地用在:被具有校准可溯源到某个RMP或CRM下的不同MP间,达到检测结果在医学上有意义限值内的等同。但是,在ISO 17511内叙述的标准化原则,具有2个关键局限性。一个是缺少存在的纯物质CRM和RMP。由于技术的局限性,对检验医学中上百个重要的、但很复杂的被测量没有形成需要的CRM和RMP。在前述的情况下,校准可溯源至一个以基质为基础的CRM,但仅可用于相对很少数量的被测量。第二个局限性是,许多以基质为基础的CRM,与患者样品还没有被确认具有互换性,许多情况下是不可互换的,因此不适用于在ISO17511依从的校准溯源性等级中。事实上,追踪校准到一个不可互换的CRM,将引起不同MP间对临床样品结果的差异。例如,5个市售可用的甲状旁腺激素MP,对患者样品结果具有1.4~4.2倍差异,引起医学治疗决定的误差。
Dr Miller长期来一致在关注临床实验室检测结果的一致性。因为这是临床实验室检测始终在追求的目标。尽管在十余年前,溯源性成为大家关注和追求的目标。但是,大量的被测量(分析物)按照溯源性文件ISO17511的溯源等级来看,真正能够挂上“溯源性”队列的太少!而且还发现了已经被认可具有溯源性的被测量,因为与天然患者样品间不具有互换性,被等于取消的号称溯源性的资格。
为此,DrMiller于2010年在美国临床化学协会(AACC)年会上提出了,应该去努力研究各种途径,尽可能使不同的实验室某个被测量的现有检测方法(MP),对相同患者可以得到一致的结果,实现一致性(Harmonization)。并且成立了国际临床实验室结果一致性联合会(ICHCLR),以此推动全球为实现检测结果一致性。
一致性是标准化概念的概括。意即在使用科学上合理的方式。使不同MP间得到的检测结果,在医学上有意义的限值内是等同的。上述叙述的标准化是在合适的CRM和/或RMP可用下,得到一致性的特定情况。2010年AACC组织的一个国际会议上讨论了,对被测量没有纯物质的CRM、RMP、或可互换的基质为基础的CRM可用下,讨论了挑战和推荐的解决方式。一个来自会议的推荐是,在某个被测量,在技术上还没有可行RMP、在合理的时间阶段和可互换的基质为基础的CRM在制备上还很有挑战下,形成一致性方案,提供了协同过程,以达到等同结果。
2017年2月,在欧洲临床化学和检验医学杂志(CCLM)上,著名学者Dr Thienpont等报告了形成步进式方式的促甲状腺素一致性第四阶段报告,使14个市售的MP达到结果一致。本报告是系列报告的高峰,形成了一致性方案的学科。这个成功的一致性方案的报告,在检验医学是一个重要进展,因为它展现了一个方式,在没有CRM或RMP可用于校准溯源性下,去实现不同MP检测患者结果间的符合目的的一致。一个一致性方案代表了对大量被测量的校准溯源性的一个实用方法,不然,这些被测量依然不一致,对医学决定潜在地带来误差。
这个一致性方案使用了天然的各个血清样品组合,满足了一致性参考物质的角色。使用各个样品组合的关键优点是,互换性问题没有影响它们用作一致性参考物质,因为它们是样品,被预期由MP检测的。尽管会出现个别样品的样品特定影响,但影响可以被证实和被统计方法处理。该方案包括选择个体的指标,作为样品供体,用于各个阶段,从使用正常甲状腺功能的供体,到评估MP性能;在被每个MP市售厂商应用的重新校准算法中,使用的组合包括低-甲状腺和高-甲状腺功能患者。作者送交的这个过程,作为一致性递升的方法,因为在MP厂商和IFCC的甲状腺功能检测标准化委员会间的合作期间,满足了多个条件和原则证明步骤。
在这个工作的技术挑战间,形成了对各个样品组合定值的稳健统计方法。另一个挑战是形成了一个方法,去保持整个时间的一致性,由于可用的各个样品的组合的体积有限。作者形成了按照相同指标制备的各个样品的不同组合;与阶段Ⅳ组合相同实验进行定值。连续的组合确保一个作用,在以后的步骤中保持重新校准,以及提供以后的组合与原先的重新校准组合的联系。一致性方案的最后关键组分,是在整个时间内监督MP结果间的连续一致性。该报告提议了,依据医学实验室的反馈计划,使用一个患者样品结果在整个时间内监视一致性。另一个监督方法可以是以可互换样品的能力验证试验或室间质量评估。
国际临床实验室结果一致性联合会(theInternational Consortium for Harmonization of Clinical Laboratory Results)认识到一致性方案的重要性,作为被ISO认可的校准溯源性等级之一。ISO TC 212于2016形成了一个提议上交和被批准。这是新的ISO/NP 21151标准:体外诊断医学设施 -- 生物样品中量值的检测 -- 预期为产品(终点用户)校准品和患者样品定值建立计量溯源性国际一致性的国际一致性方法的要求。当这个新的标准完成和发布时,一致性方案,可列入JCTLM的标准,使得MP的厂商达到对相同被测量的不同MP间一致的结果。
7年过去了。我的公众微信号5月8日写过一篇文章:“大数据观察促甲状腺素(TSH)检测结果结果的季节性变化”。这是国际上著名的Dr LindaThienpont的伟大工作。DrThienpont在带领她的工作组“IFCC的甲状腺功能检测标准化委员会”,对促甲状腺激素(TSH)直接以患者样品作为临时校准品,采用稳健的统计方法,逐步从正常甲状腺功能患者样品开始,一致到使用低-甲状腺功能和高-甲状腺功能样品,反复使用和比较,终于使今天的患者样品TSH检测结果的实验室间比对的CV低于3%!也因此,可以在德国、英国和日本,对一年多大批量样品的检测数据分析,得到了TSH结果有季节性变化的结论!
这些工作是在没有TSH的参考物质和参考方法下,依靠患者样品比对、使用合适统计方法实现了TSH检测结果的可比性!而且这样的工作方案,也已经得到了ISO的认可,正在形成标准发布。
为此,DrMiller为美国临床化学杂志写了社论“一致性的时间来临了”。表明,新的溯源性做法,将有力推动某些类似于甲状腺功能的一些检测分析物,可以实现全世界常规实验室检测结果的可比性和一致性。
这就是已经将这样的溯源过程列为ISO17511文件认可的一个溯源内容。
如果对这个内容希望有更多的理解,可以翻阅我去年写来的一些微信内容。
(待续)
来源:微信公众号“冯仁丰”















