这个计量溯源性情况是,既没有国际公认的参考物质;也没有国际认可的参考检测程序;但是具有国际约定的方案,去确定国际约定校准品(conventionalmaterials)的定值。不可以计量溯源到SI。这类分析物或被测量,在临床实验室目前的检测项目中,占有很大的一部分。
5 计量溯源性的校准转换方案的模式
5.4 具有国际约定的校准品(不是一级),确定了被测量;没有较高等级的参考物质或参考检测程序,以及没有计量溯源性到SI(图4)
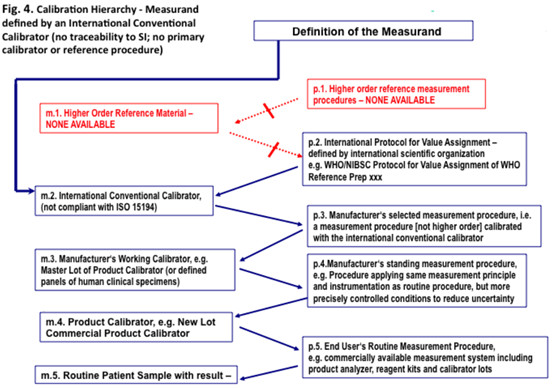
图4 校准层次- 由一个国际约定的校准品(没有溯源性至SI;没有一级校准品或参考程序)
5.4.1 图4叙述的校准层次,应应用到检测人样品中可检测分析物量,但没有明确的和国际一致的参考检测程序,没有一级参考物质或约定的参考检测程序,以及没有溯源性至SI。
5.4.2 在这个情况下的国际约定校准品(m.2)是含有被测量的制品。
注1:在这样的一个参考物质内的被测量,通常存在于一个很好的特征形式,一般含有具有类似于在终点用户的常规检测程序检测的人原始样品内的基质。
注2:被测量会在的一个基质内,较人原始样品内的简单,在这种情况下,可能需要调整国际常规校准品的基质以实现所需的特性(例如可互换性),以适合用作预期用于检测程序的校准品。
注3:一个国际约定的校准品可以是一个单一物质、或多重物质,如,一组样品,每一个具有被测量的不同量。
注4:要求具有足够量的一个国际约定校准品,使之在一个较长时间内可用。
5.4.3 一个国际上一致的方案(p.2),被用于为国际约定校准品(m.1)设定量值。
注1:方案的一个示例是一个计划,由一组具有合适性能特性的、具有资格的检测程序,检测国际约定校准品(去除离群点后)确定均值。确定性能特性的合适性,应以检测一组人原始样品的结果为基础,并包括,特别是,在使用候选的国际约定校准品重新校准程序间,考虑不精密度、特异性、相关、程序间差异的减少;连同其他关键影响量。
注2 :WHO的生物标准化专家委员会(ECBS)建立了国际生物参考物质,被称为“国际标准(IS)”(和以往的“国际参考制品(IRP)”)用于生物程序和免疫程序(见附录A,WHO)。作为第一批这样的物质,要确定一个“国际单位”作为一个人为指定的物质量。由它的特定生物活性予以确定。以后的批量被实验室间合作检测。相对于前一批物质予以校准。在一个系列批中被命名为“1st IS”、“2nd IS”等。这样参考物质的设定值,即使为高度纯化的,与一个专用生物检测程序有关,而无计量溯源性至SI。这样的物质,所以,不可被称为一级参考物质。
注3:一个国际约定的校准物质(如,一个WHO国际标准)仅可被用作校准品,如果该物质已经依据与预期临床应用关联的量的明确定义为基础形成的,以及若该物质设定的值具有的不确定度,在常规检测系统的校准中为可接受。一些WHO 国际标准原先预期被用作体内检测程序依据生物活力(特别为治疗目的)为基础的校准品。这样的物质用于体外免疫程序的校准,会存在一些问题。
注4:一个检测结果给出的结果没有计量上可溯源至SI的,可依然要求设备需要这样的溯源性,如涉及容量、时间、质量和压力。
5.4.4对一个代表数量的、预期被使用的检测程序,应确认它们对国际约定校准品与人的原始样品的互换性。
注1:国际约定校准品会不可用在适合直接用作检测程序的校准品。国际约定校准品一般呈粉状的或冻干物,使用前要求以合适的稀释剂复溶稀释。这样制备的校准品,具有的基质应类似于被终点用户常规检测程序检测的人原始样品内基质,有助于确保参考物质(m.2)在检测程序(如,p.3或p.4)中是可互换的,在确定的值转换层次中去校准。警示:使用类似样品的基质,没有确保最后的校准品事实上是一个可互换的物质。
注2:依据选择的p.5程序(也会被用于p.4或p.3)在市场中预期用户的份额,在不同检测程序中使用的技术上的差异,与其他等,被选择为一个代表数量的检测程序。
注3:一个国际约定校准品的提供者应进行合理的努力,以导入一个有意义的互换性评估。但是,考虑费用和物流会限制互换性评价的范围。
注4:终点用户负责更多的互换性评价,需要确保一个国际约定校准品在一个给定的校准层次上适合用于一个特定的检测程序。
注5:可用的互换性评估方案,可见CLSI文件EP30-A,检验医学中可互换参考物质的特性和资格。
5.4.5一个国际约定校准品(m.2),即不可溯源至SI单位的,应被用于校准厂商选定的检测程序(p.3),它不是一个参考检测程序。
注:厂商选定的检测程序可与厂商常设检测程序(p.4)或常规检测程序(p.5)相同,但在精密得多的控制条件下实施,以减少检测量的不确定度。
5.4.6厂商选定的检测程序(p.3)应确定某个检测系统,由一个或多个国际约定校准品校准。选定的检测程序,在被相应校准下,应被用于为厂商工作校准品(m.3)设定值。
5.4.7厂商工作校准品(m.3)应由厂商选定的检测程序(p.3)设定值。这个校准品有时被称为“厂商的一级(master)校准品”(或“内部校准品”)。厂商工作校准品(m.3)应在厂商的选定检测程序(p.3)和厂商的常设检测程序中展现了互换性。
注1:厂商工作校准品可以是,如具有基质的物质,类似于终点用户的常规检测程序检测的人原始样品那样。
注2:厂商的工作校准品可以是一组人临床样品。
5.4.8厂商的常设检测程序(p.4)应确定一个检测程序,被一个或多个厂商工作校准品(m.3)或较高类型的校准品如国际约定校准品(m.2)校准;并对其分析特异性予以确认。
注:厂商选定的检测程序(p.4)可以与常规检测程序(p.5)、或依据相同检测原理和方法,但在较精确的控制统计下操作,以减少检测量的不确定度。
5.4.9厂商产品校准品(m.4)应由厂商的常设检测程序为之定值,被预期为临床实验室使用的常规检测程序校准。
注1:厂商产品校准品可以是,如具有基质的物质,类似于被终点用户的常规检测程序检测的人原始样品。
注2:厂商的产品校准品会与人原始样品不可互换,在这个情况下可以设定对程序特定的校正因子,去校正不可互换性的大小,使得对病人样品设定的值可溯源至国际约定的校准品(m.2)。
5.4.10临床实验室使用常规检测程序(p.5),应成为一个检测系统,经常由厂商提供,以一个或多个厂商的产品校准品校准。
5.4.11在谋和校准层次(一个校准品和程序对)被消除下,可以减少不确定度。见第5.1.3节的限定。
(待续)
来源:微信公众号“冯仁丰”















