卫生标准 | 血清肌酐测定参考方法同位素稀释液相色谱串联质谱法
发布日期:2019-10-17 来源:国家卫生健康委员会 临床质谱网 浏览数:3858 人
本期给大家带来一篇由国家卫生和计划生育委员会2013年6月发布,于2013年12月开始实施的卫生行业推荐性标准——血清肌酐测定参考方法同位素稀释液相色谱串联质谱法。标准号为WS/T 413-2013。该标准涉及的内容包括测定原理和方法、试剂、仪器、样本处理方法、液相色谱串联质谱测定等。
1 范围
本标准规定了血清肌酐测定参考方法的技术要求,包括样本采集与处理、仪器测定、数据分析和不确定度分析等内容。
本标准适用于实验室血清肌酐的测定。
2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注目期的引用文件,仅注日期的版本用于本文件,凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/ T6682分析实验室用水规格和试验方法
JJF 1135化学分析测量不确定度评定。
3 术语和定义
下列术语和定义适用于本文件。
3.1
参考测量方法 reference measurement method
经过充分研究的测量方法,其测量值的测量不确定度适合其预期用途,用于评价测量相同量的其他测量方法的正确性和鉴定参考物质方面的用途。
3.2
溯源性 traceability
通过一条具有规定不确定度的不间断的比较链,使测量结果或测量标准的值能够与规定的参考标准(通常是与国家测量标准或国际测量标准)联系起来的特性。
3.3
互通性 commutability
临床检验参考物质或校准物质的互通性,指用不同测量过程测量该物质时,各测量过程测量结果之间的数字关系,与用这些测量过程测量实际临床样本时测量结果的数字关系的一致程度,亦即该物质理化性质与实际临床样本的接近程度。
4 测定原理和方法
本标准建立的血清肌酐参考测量方法以同位素稀释质谱法为测定原理。该法是以稳定同位素标记的肌酐为内标添加至血清中,内标与血清均匀混合后用无水乙醇沉淀蛋白质,用三氯甲烷净化上清液,用液相色谱串联质谱分离和测定血清肌酐和内标特异的离子转变。用肌酐和内标峰面积比计算血清肌酐浓度。
5 试剂
5.1 水(H2O):除非有特别说明,应使用GB/T 6682定义的一级实验用水。
5.2 无水乙醇(CH3CH2OH):色谱纯
5.3 三氯甲烷(CHCl3):色谱纯。
5.4 乙腈(CH2CN):色谱纯。
5.5 乙酸铵(CH3 COONH4):纯度≥99%
5.6 乙酸(CH3COOH):纯度≥99%。
a)高效液相色音仪;
液相色谱柱应满足以下要求:
a)具有极性官能团嵌入或端基封尾的C18键合色谱柱,在含水量高的流动相中具有良好的稳定性和重现性;
b)规格为内径2.0 mm~2.1 mm,粒径3μm~5μm,柱长150mm。
6.3 天平
十万分之一天平(最小分度0.01mg),应校准合格并在强制检定周期内。
6.4 离心机
水平转头离心机。离心力应能达到1500 g。
6.5 旋涡式混合器
适用于安瓿、试管等的旋涡式混合装置。
6.6 加热吹干装置
加热方式应为干热,不宜使用水浴加热的装置。
6.7 微量移液器
经校准合格的微量移液器两支,规格分别为1000μL和200μL。
6.8 血液混匀器
适用于安瓿、密封瓶等的血液或液体混匀装置。
6.9 安瓿或试管
规格5mL。试管应配有聚四氟乙烯密封塞。安瓿应配有融封装置。
7 样本
7.1 通则
本参考测量方法适用于新鲜冰冻或冻干血清样本的肌酐浓度测定。
在处理样本时,应该严格遵从对潜在生物传染性样本处理的相关规定。使用时遵循生物安全规则,并根据规定对废物进行处理。
7.2 样本用量
样本所需用量根据肌酐的浓度确定,一般用量为0.1 mL~0.4 mL。为保证取样量的准确性和操
作可行性,最小取样量不得低于0.1 mL。
7.3 样本的保存
新鲜血清样本若不立即测定,应于-20℃冰冻保存,保存时间不应超过3个月。长期保存应置于-70℃以下,可稳定保存至少1年。使用前应在室温下将血清融化、充分混匀。冻干样本应按照说明书描述的使用期限和条件保存,临用前按照说明复融重组,充分混匀。
8 测定系统和分析部分的准备
8.1 液相色谱串联质谱联用系统的准备
8.1.1 质谱系统部分的准备
测定前应对质谱系统进行性能检查,包括:
a)最近3个月内进行过质量校准并合格。若上一次质量校准时间与测定时间超过3个月,应重
新校准至合格;
b)离子源装配电喷雾离子源,运行正常;
c)真空度达到正常工作要求的范围。所需辅助气体纯度符合要求、供应充足、气路通畅。
8.1.2 液相系统部分准备
测定前应对液相系统进行准备,包括:
a)流动相准备:纯水,乙酸铵水溶液;
b)色谱柱的平衡:用流动相(见9.2)冲洗色谱柱约30~40倍柱床体积,直至色谱柱达到平衡。
8.2 校准溶液的准备
8.2.1 校准物质
8.2.1.1 纯度标准物质
应使用肌酐纯品的国际有证标准物质或国家一级标准物质为校准物质。校准物质的使用、保存及使用期限应符合标准物质研制机构提供的标准物质证书。
8.2.1.2 同位素标记物质
应使用稳定同位素标记的肌酐为内标,标记的稳定同位素个数应不低于3个。内标的使用、保存及使用期限应符合生产厂商提供的产品证书或使用说明书。
8.2.2 校准溶液的制备
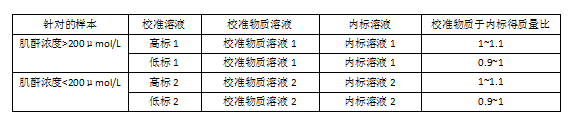
本法使用包括法( bracketing method校准。用重量法制备肌酐纯度标准物质(见8.2.1.1)的水溶液为校准物质溶液:配制浓度约为0.10 mg/g的校准物质溶液用于肌酐浓度大于200μmol/L样本的测定(简称为校准物质溶液1);配制浓度约为0.01 mg/g的校准物质溶液用于肌酐浓度小于200μmol/L样本的测定(简称为校准物质溶液2)记录称量过程,准确计算所配制校准物质溶液的浓度。校准物质溶液应于一70℃以下保存。
用重量法制备稳定同位素标记肌酐(见8.2.1.2)的水溶液为内标溶液:配置浓度约为0.10 mg/g的内标溶液用于肌酐浓度大于200μmo/L样本的测定(简称为内标溶液1);配制浓度约为0.01 mg/g的内标溶液用于肌酐浓度小于200μmo/L样本的测定(简称为内标溶液2)。记录称量过程,准确计算所配制内标溶液的浓度。内标溶液应于一70℃以下保存。
用重量法将校准物质溶液与其对应浓度的肉标养溶液按照一定比例精确混合,制成高低两个浓度水平的校准溶液(见表1)。要求其中一个校准溶液(简称为低标,其中用于肌酐浓度大于200μmol/L样本测定的记为低标1,用于肌酐浓度小于200μmol/L样本测定的记为低标2)所含肌酐校准物质与内标的质量比控制在0.9~1之间,另一个校准溶液(简称为高标,其中用于肌酐浓度大于200μmol/L样本测定的记为高标1,用于肌酐浓度小于200μmol/L样本测定的记为高标2)所含肌酐校准物与内标的质量比控制在1~1.1之间。准确记录所取校准物质溶液与内标溶液的质量,十算校准溶液中肌酐校准物质与内标质量的精确比例。
注1:可在校准物质溶液和内标溶液中加入0.1%叠氮钠作为防腐剂。
注2:样本浓度划分的依据是操作的可行性与合理性(见8.3.7),不是临床医学决定水平。
8.3 分析样本的处理
8.3.1 常规方法测定肌酐浓度
在分析前,使用常规方法(如碱性苦味酸法或酶法)初步测定各种分析样本中肌酐的浓度.
8.3.2 测定血清密度
在分析前,应准确测定血清样本的密度,所得结果应保留4位有效数字.
8.3.3 样本前处理流程图
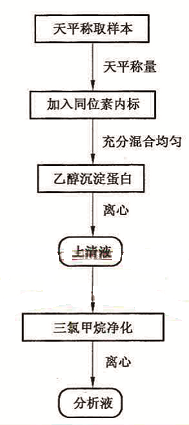
样本前处理流程见图1。
8.3.4 分析样本与内标的混和
用微量移液器取约0.1 mL~0.4 mL样本,称重得其精确质量。用微量移液器取约0.1mL内标溶液,称重得其精确质量,加入样本中充分混合。所取样本的量应使其所含肌酐与内标的质量比约为1:1。肌酐浓度大于200μmol/L的样本使用浓度约为0.10mg/g的内标溶夜,肌酐浓度小于200μmol/L的样本使用浓度约为0.01mg/g的内标溶液。
加入适量水,使其终体积约为0.5mL,轻轻混匀,室温下放置1h平衡。
8.3.5 去除蛋白
加入2mL无飞yichun ,涡旋振荡5min后以1500g离心力离心5min。取2mL上清液至安瓿或试管中,60℃氮气流下吹干。
8.3.6 提取净化
残渣溶于0.6mL水中,加入0.6mL三氢甲烷,涡旋振荡5min后以1500g离心力离心5min。将水相移至2mL色谱分析样本瓶中进行液相色谱串联质谱分析。
8.3.7 高浓度样本的处理
为保证取样量的准确性,要求最小取样量不得低于0.1mL。当样本肌酐浓度大于850μmol/L,取样量不满足要求时,可增加样本的量以到达最小取样量要求,同时相应增加内标溶液的加入量,使其中所含肌酐与内标的质量比仍保持约为1:1。仪器分析前将样本用流动相稀释,使其保持与其他样本一致的浓度水平。
注:高值样本是根据操作的可行性与合理性而设定的,不是临床医学决定水平。
示例:样本肌酐浓度约为1150μmoL/L,取该血清约0.15mL,称重得其精确质量,加入0.2mL浓度为0.10mg/g的内标溶液,称重得其精确质量,混匀。按照8.3进行样本前处理,LC/MS/MS测定前将样本稀释2倍,设定进样体积为1μL。
9 液相色谱串联质谱系统(LC/MS/MS)测定
9.1 LC/MS/MS使用前检查
测定前检查LC/MS/MS,使其符合8.1的要求。
9.2 液相色谱测定条件
流动相为5 mmol/L乙酸铵(pH5.5,100%水相),流速为0.2mL/min。肌酐浓度小于200μmo/L样本的进样体积为10μL,肌酐浓度大于200μmol/L,样本的进样体积为1μL。
9.3 串联质谱测定条件
9.3.1 数据采集模式
使用电喷雾电离源(ESI)正离子模式和多反应监测(MRM)模式分析。监测的母离子为[M+H]+,子离子为母离子失去一个羰基后的碎片离子,即监测肌酐m/z 114→86的离子转变和同位素内标相应的离子转变。
注:选用不同的同位素内标,所监测的内标离子转变将有所不同,应根据其标记同位素的数量和位置确定。
9.3.2 辅助气体、离子源条件参数的设置
调整辅助气体、离子源条件等参数的设置,使肌酐和内标色谱峰的信噪比达到最佳。
9.4 分析过程
9.4.1 分析系列
每个样本与其对应浓度水平的校准溶液(即低标和高标)同一批测定,其中肌酐浓度大于200μmol/L的样本使用低标1和高标1,肌酐浓度小于200μmol/L的样本使用低标2和高标2,每个样本至少重复测定3次。分析的顺序如下为:
第一次:低标;样本1;样本2;…高标;
第二次:高标;样本1;样本2;…低标;
第三次:低标;样本1;样本2;…高标;
9.4.2 原始数据的有效性检查
要求三次重复测定所得肌酐和内标的峰面积比的变异系数小于1%。应按照8.1的要求进行仪器准备,保证测定数据符合要求。
10 数据处理
10.1 有效数据
符合9.4要求的3次重复测定结果的均值为样本测定的有效数据。
10.2 结果计算
使用包括法计算血清肌酐浓度,计算公式见(1):
ISam —样本中肌酐与内标的峰面积比(测定值);
ILow —低标中肌酐与内标的峰面积比(测定值);
IHi —高标中肌酐与内标的峰面积比(测定值);
WLow —低标中肌酐与内标的含量比;
WHi —压—高标中肌酐与内标的含量比;
QIs —血清样本中内标的含量,单位为微克(pg);
MSer —血清样本的质量,单位为克(g);
DS —血清的密度;
PStD —校准品的认定纯度(由标准物质证书提供);
113 —肌酐的相对分子质量。
11 分析可靠性
11.1 不确定度评估
11.1.1 不确定度来源分析
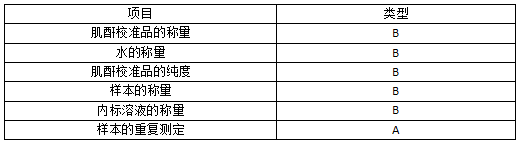
本标准的血清肌酐参考测量程序以同位素稀释质谱法为测定原理,以包括法为校准方法。校准溶液的配制、样本和内标的添加使用重量法。分析测定的不确定度主要来源见表2
11.1.2 不确定度的计算
根据JJF 1135和11.1.1中不确定度主要来源计算合成不确定度(uc)。以包含因子k为2,计算扩展不确定度(U)与相对扩展不确定(Urel)。
测定结果的相对扩展不确定度应≤2%。
11.2 加样回收实验
以肌酐标准物质(见8.2.1.1)为标准品,添加至待测血清中,混合均匀。用所建测量程序测定添加标准品前后的肌酐浓度。计算方法的加样回收率。
加样回收率应在(100±2)%范围之间。
11.3 测定有证标准物质
测定血清肌酐的国际有证标准物质或国家一级标准物质,所得结果应在标准物质(认定值±不确定度)的范围之间。
应使用与校准物质(见8.2.1.1)不同的有证标准物质用于正确性验证
示例:美国国家标准和技术研究院(NIST)有证标准物质SRM 909b和SRM 967b。
11.4 测定精密度
为保证测定结果的可靠性,应对样本进行重复性测定,包括批内试验和批间试验测定结果的批内和批间不精密度应≤2%。
12 实验室间验证
除按照11的要求对所使用的测定过程进行分析可靠性的研究,还应通过有计划的实验室间研究进行验证,测定结果应符合所参加实验室间研究的要求。
示例:参加由国际临床化学联合会(IFCC)和德国临床化学与检验医学学会(DGKL)共同组织的环形比对试验(Ring Trials)。
13 特殊情况
使用本标准描述的参考测量方法测定制备物(如质控品和校准品)或有证标准物质的肌酐浓度,其结果不能直接用于肌酐常规测定方法的校准。应考察制备物或有证标准物质的互通性对肌酐常规测定方法的影响。
14 报告
14.1 样本来源的说明
应报告样本的类型:新鲜冰冻或冻干。
应报告样本的保存方式和保存时间。
重组的样本应同时报告重组的过程。
14.2 使用测量程序的说明
应说明所使用测量程序的原理:同位素稀释液相色谱串联质谱法。
应报告所使用校准物质的溯源性、名称和认定纯度。
14.3 测定结果
报告血清肌酐浓度的单位为微摩尔每升(μmol/L)。
应报告测定结果的不确定度。
[1] 张天娇,赵海舰张传宝,等同位素稀释液相色谱串联质谱法测定血清肌酐中华检验医学杂志,2009,32(5):509-514
[2] Stokes P,O'Connor G. Development of a liquid chromatography-mass spectrometry methodfor the high-accuracy determination of creatinine in serum. Journal of Chromatography B, 2003, 794 125-136
[3] 张传宝,陈忠余,马嵘,等.血清肌酐测定基质效应的研究.中华检验医学杂志.2009,32(5):515-520
[4] IFCC External quality assessment scheme for reference( calibration) laboratories in laboratory medicineproceduresWebsite:http://www.dgkl-rfb.de:8_1/ifcc_eqaSProcmanual.pdf
[5] ISO 15193 In vitro diagnostic systems--Measurement of quantities in samples of biological origin-Presentation of reference measurement procedures. ISO, Geneva, Switzerland(2002)
[6] Joint Committee for Traceability in Laboratory Medicine, PREAMBLE(2004).Website http://www.bipm.org
1 范围
本标准规定了血清肌酐测定参考方法的技术要求,包括样本采集与处理、仪器测定、数据分析和不确定度分析等内容。
本标准适用于实验室血清肌酐的测定。
2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注目期的引用文件,仅注日期的版本用于本文件,凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/ T6682分析实验室用水规格和试验方法
JJF 1135化学分析测量不确定度评定。
3 术语和定义
下列术语和定义适用于本文件。
3.1
参考测量方法 reference measurement method
经过充分研究的测量方法,其测量值的测量不确定度适合其预期用途,用于评价测量相同量的其他测量方法的正确性和鉴定参考物质方面的用途。
3.2
溯源性 traceability
通过一条具有规定不确定度的不间断的比较链,使测量结果或测量标准的值能够与规定的参考标准(通常是与国家测量标准或国际测量标准)联系起来的特性。
3.3
互通性 commutability
临床检验参考物质或校准物质的互通性,指用不同测量过程测量该物质时,各测量过程测量结果之间的数字关系,与用这些测量过程测量实际临床样本时测量结果的数字关系的一致程度,亦即该物质理化性质与实际临床样本的接近程度。
4 测定原理和方法
本标准建立的血清肌酐参考测量方法以同位素稀释质谱法为测定原理。该法是以稳定同位素标记的肌酐为内标添加至血清中,内标与血清均匀混合后用无水乙醇沉淀蛋白质,用三氯甲烷净化上清液,用液相色谱串联质谱分离和测定血清肌酐和内标特异的离子转变。用肌酐和内标峰面积比计算血清肌酐浓度。
5 试剂
5.1 水(H2O):除非有特别说明,应使用GB/T 6682定义的一级实验用水。
5.2 无水乙醇(CH3CH2OH):色谱纯
5.3 三氯甲烷(CHCl3):色谱纯。
5.4 乙腈(CH2CN):色谱纯。
5.5 乙酸铵(CH3 COONH4):纯度≥99%
5.6 乙酸(CH3COOH):纯度≥99%。
5.7 叠氮钠(NaN3):分析纯。
6.1 液相色谱串联质谱联用系统
a)高效液相色音仪;
b)三重四极杆串联质谱仪,配有电喷雾离子源(ESI),质量校正合格,各项参数指标符合正常工作的要求。
液相色谱柱应满足以下要求:
a)具有极性官能团嵌入或端基封尾的C18键合色谱柱,在含水量高的流动相中具有良好的稳定性和重现性;
b)规格为内径2.0 mm~2.1 mm,粒径3μm~5μm,柱长150mm。
6.3 天平
十万分之一天平(最小分度0.01mg),应校准合格并在强制检定周期内。
6.4 离心机
水平转头离心机。离心力应能达到1500 g。
6.5 旋涡式混合器
适用于安瓿、试管等的旋涡式混合装置。
6.6 加热吹干装置
加热方式应为干热,不宜使用水浴加热的装置。
6.7 微量移液器
经校准合格的微量移液器两支,规格分别为1000μL和200μL。
6.8 血液混匀器
适用于安瓿、密封瓶等的血液或液体混匀装置。
6.9 安瓿或试管
规格5mL。试管应配有聚四氟乙烯密封塞。安瓿应配有融封装置。
7 样本
7.1 通则
本参考测量方法适用于新鲜冰冻或冻干血清样本的肌酐浓度测定。
在处理样本时,应该严格遵从对潜在生物传染性样本处理的相关规定。使用时遵循生物安全规则,并根据规定对废物进行处理。
7.2 样本用量
样本所需用量根据肌酐的浓度确定,一般用量为0.1 mL~0.4 mL。为保证取样量的准确性和操
作可行性,最小取样量不得低于0.1 mL。
7.3 样本的保存
新鲜血清样本若不立即测定,应于-20℃冰冻保存,保存时间不应超过3个月。长期保存应置于-70℃以下,可稳定保存至少1年。使用前应在室温下将血清融化、充分混匀。冻干样本应按照说明书描述的使用期限和条件保存,临用前按照说明复融重组,充分混匀。
8 测定系统和分析部分的准备
8.1 液相色谱串联质谱联用系统的准备
8.1.1 质谱系统部分的准备
测定前应对质谱系统进行性能检查,包括:
a)最近3个月内进行过质量校准并合格。若上一次质量校准时间与测定时间超过3个月,应重
新校准至合格;
b)离子源装配电喷雾离子源,运行正常;
c)真空度达到正常工作要求的范围。所需辅助气体纯度符合要求、供应充足、气路通畅。
8.1.2 液相系统部分准备
测定前应对液相系统进行准备,包括:
a)流动相准备:纯水,乙酸铵水溶液;
b)色谱柱的平衡:用流动相(见9.2)冲洗色谱柱约30~40倍柱床体积,直至色谱柱达到平衡。
8.2 校准溶液的准备
8.2.1 校准物质
8.2.1.1 纯度标准物质
应使用肌酐纯品的国际有证标准物质或国家一级标准物质为校准物质。校准物质的使用、保存及使用期限应符合标准物质研制机构提供的标准物质证书。
8.2.1.2 同位素标记物质
应使用稳定同位素标记的肌酐为内标,标记的稳定同位素个数应不低于3个。内标的使用、保存及使用期限应符合生产厂商提供的产品证书或使用说明书。
8.2.2 校准溶液的制备
本法使用包括法( bracketing method校准。用重量法制备肌酐纯度标准物质(见8.2.1.1)的水溶液为校准物质溶液:配制浓度约为0.10 mg/g的校准物质溶液用于肌酐浓度大于200μmol/L样本的测定(简称为校准物质溶液1);配制浓度约为0.01 mg/g的校准物质溶液用于肌酐浓度小于200μmol/L样本的测定(简称为校准物质溶液2)记录称量过程,准确计算所配制校准物质溶液的浓度。校准物质溶液应于一70℃以下保存。
用重量法制备稳定同位素标记肌酐(见8.2.1.2)的水溶液为内标溶液:配置浓度约为0.10 mg/g的内标溶液用于肌酐浓度大于200μmo/L样本的测定(简称为内标溶液1);配制浓度约为0.01 mg/g的内标溶液用于肌酐浓度小于200μmo/L样本的测定(简称为内标溶液2)。记录称量过程,准确计算所配制内标溶液的浓度。内标溶液应于一70℃以下保存。
用重量法将校准物质溶液与其对应浓度的肉标养溶液按照一定比例精确混合,制成高低两个浓度水平的校准溶液(见表1)。要求其中一个校准溶液(简称为低标,其中用于肌酐浓度大于200μmol/L样本测定的记为低标1,用于肌酐浓度小于200μmol/L样本测定的记为低标2)所含肌酐校准物质与内标的质量比控制在0.9~1之间,另一个校准溶液(简称为高标,其中用于肌酐浓度大于200μmol/L样本测定的记为高标1,用于肌酐浓度小于200μmol/L样本测定的记为高标2)所含肌酐校准物与内标的质量比控制在1~1.1之间。准确记录所取校准物质溶液与内标溶液的质量,十算校准溶液中肌酐校准物质与内标质量的精确比例。
注1:可在校准物质溶液和内标溶液中加入0.1%叠氮钠作为防腐剂。
注2:样本浓度划分的依据是操作的可行性与合理性(见8.3.7),不是临床医学决定水平。
表1 校准溶液的配置

8.3 分析样本的处理
8.3.1 常规方法测定肌酐浓度
在分析前,使用常规方法(如碱性苦味酸法或酶法)初步测定各种分析样本中肌酐的浓度.
8.3.2 测定血清密度
在分析前,应准确测定血清样本的密度,所得结果应保留4位有效数字.
8.3.3 样本前处理流程图
样本前处理流程见图1。

图1 样本的处理流程
8.3.4 分析样本与内标的混和
用微量移液器取约0.1 mL~0.4 mL样本,称重得其精确质量。用微量移液器取约0.1mL内标溶液,称重得其精确质量,加入样本中充分混合。所取样本的量应使其所含肌酐与内标的质量比约为1:1。肌酐浓度大于200μmol/L的样本使用浓度约为0.10mg/g的内标溶夜,肌酐浓度小于200μmol/L的样本使用浓度约为0.01mg/g的内标溶液。
加入适量水,使其终体积约为0.5mL,轻轻混匀,室温下放置1h平衡。
8.3.5 去除蛋白
加入2mL无飞yichun ,涡旋振荡5min后以1500g离心力离心5min。取2mL上清液至安瓿或试管中,60℃氮气流下吹干。
8.3.6 提取净化
残渣溶于0.6mL水中,加入0.6mL三氢甲烷,涡旋振荡5min后以1500g离心力离心5min。将水相移至2mL色谱分析样本瓶中进行液相色谱串联质谱分析。
8.3.7 高浓度样本的处理
为保证取样量的准确性,要求最小取样量不得低于0.1mL。当样本肌酐浓度大于850μmol/L,取样量不满足要求时,可增加样本的量以到达最小取样量要求,同时相应增加内标溶液的加入量,使其中所含肌酐与内标的质量比仍保持约为1:1。仪器分析前将样本用流动相稀释,使其保持与其他样本一致的浓度水平。
注:高值样本是根据操作的可行性与合理性而设定的,不是临床医学决定水平。
示例:样本肌酐浓度约为1150μmoL/L,取该血清约0.15mL,称重得其精确质量,加入0.2mL浓度为0.10mg/g的内标溶液,称重得其精确质量,混匀。按照8.3进行样本前处理,LC/MS/MS测定前将样本稀释2倍,设定进样体积为1μL。
9 液相色谱串联质谱系统(LC/MS/MS)测定
9.1 LC/MS/MS使用前检查
测定前检查LC/MS/MS,使其符合8.1的要求。
9.2 液相色谱测定条件
流动相为5 mmol/L乙酸铵(pH5.5,100%水相),流速为0.2mL/min。肌酐浓度小于200μmo/L样本的进样体积为10μL,肌酐浓度大于200μmol/L,样本的进样体积为1μL。
9.3 串联质谱测定条件
9.3.1 数据采集模式
使用电喷雾电离源(ESI)正离子模式和多反应监测(MRM)模式分析。监测的母离子为[M+H]+,子离子为母离子失去一个羰基后的碎片离子,即监测肌酐m/z 114→86的离子转变和同位素内标相应的离子转变。
注:选用不同的同位素内标,所监测的内标离子转变将有所不同,应根据其标记同位素的数量和位置确定。
9.3.2 辅助气体、离子源条件参数的设置
调整辅助气体、离子源条件等参数的设置,使肌酐和内标色谱峰的信噪比达到最佳。
9.4 分析过程
9.4.1 分析系列
每个样本与其对应浓度水平的校准溶液(即低标和高标)同一批测定,其中肌酐浓度大于200μmol/L的样本使用低标1和高标1,肌酐浓度小于200μmol/L的样本使用低标2和高标2,每个样本至少重复测定3次。分析的顺序如下为:
第一次:低标;样本1;样本2;…高标;
第二次:高标;样本1;样本2;…低标;
第三次:低标;样本1;样本2;…高标;
9.4.2 原始数据的有效性检查
要求三次重复测定所得肌酐和内标的峰面积比的变异系数小于1%。应按照8.1的要求进行仪器准备,保证测定数据符合要求。
10 数据处理
10.1 有效数据
符合9.4要求的3次重复测定结果的均值为样本测定的有效数据。
10.2 结果计算
使用包括法计算血清肌酐浓度,计算公式见(1):
![]()
式中:
c —血清中肌酐的浓度,单位为微摩尔每升(mol/L);ISam —样本中肌酐与内标的峰面积比(测定值);
ILow —低标中肌酐与内标的峰面积比(测定值);
IHi —高标中肌酐与内标的峰面积比(测定值);
WLow —低标中肌酐与内标的含量比;
WHi —压—高标中肌酐与内标的含量比;
QIs —血清样本中内标的含量,单位为微克(pg);
MSer —血清样本的质量,单位为克(g);
DS —血清的密度;
PStD —校准品的认定纯度(由标准物质证书提供);
113 —肌酐的相对分子质量。
11 分析可靠性
11.1 不确定度评估
11.1.1 不确定度来源分析
本标准的血清肌酐参考测量程序以同位素稀释质谱法为测定原理,以包括法为校准方法。校准溶液的配制、样本和内标的添加使用重量法。分析测定的不确定度主要来源见表2
表2 不确定度主要来源分析表

11.1.2 不确定度的计算
根据JJF 1135和11.1.1中不确定度主要来源计算合成不确定度(uc)。以包含因子k为2,计算扩展不确定度(U)与相对扩展不确定(Urel)。
测定结果的相对扩展不确定度应≤2%。
11.2 加样回收实验
以肌酐标准物质(见8.2.1.1)为标准品,添加至待测血清中,混合均匀。用所建测量程序测定添加标准品前后的肌酐浓度。计算方法的加样回收率。
加样回收率应在(100±2)%范围之间。
11.3 测定有证标准物质
测定血清肌酐的国际有证标准物质或国家一级标准物质,所得结果应在标准物质(认定值±不确定度)的范围之间。
应使用与校准物质(见8.2.1.1)不同的有证标准物质用于正确性验证
示例:美国国家标准和技术研究院(NIST)有证标准物质SRM 909b和SRM 967b。
11.4 测定精密度
为保证测定结果的可靠性,应对样本进行重复性测定,包括批内试验和批间试验测定结果的批内和批间不精密度应≤2%。
12 实验室间验证
除按照11的要求对所使用的测定过程进行分析可靠性的研究,还应通过有计划的实验室间研究进行验证,测定结果应符合所参加实验室间研究的要求。
示例:参加由国际临床化学联合会(IFCC)和德国临床化学与检验医学学会(DGKL)共同组织的环形比对试验(Ring Trials)。
13 特殊情况
使用本标准描述的参考测量方法测定制备物(如质控品和校准品)或有证标准物质的肌酐浓度,其结果不能直接用于肌酐常规测定方法的校准。应考察制备物或有证标准物质的互通性对肌酐常规测定方法的影响。
14 报告
14.1 样本来源的说明
应报告样本的类型:新鲜冰冻或冻干。
应报告样本的保存方式和保存时间。
重组的样本应同时报告重组的过程。
14.2 使用测量程序的说明
应说明所使用测量程序的原理:同位素稀释液相色谱串联质谱法。
应报告所使用校准物质的溯源性、名称和认定纯度。
14.3 测定结果
报告血清肌酐浓度的单位为微摩尔每升(μmol/L)。
应报告测定结果的不确定度。
参考文献
[1] 张天娇,赵海舰张传宝,等同位素稀释液相色谱串联质谱法测定血清肌酐中华检验医学杂志,2009,32(5):509-514
[2] Stokes P,O'Connor G. Development of a liquid chromatography-mass spectrometry methodfor the high-accuracy determination of creatinine in serum. Journal of Chromatography B, 2003, 794 125-136
[3] 张传宝,陈忠余,马嵘,等.血清肌酐测定基质效应的研究.中华检验医学杂志.2009,32(5):515-520
[4] IFCC External quality assessment scheme for reference( calibration) laboratories in laboratory medicineproceduresWebsite:http://www.dgkl-rfb.de:8_1/ifcc_eqaSProcmanual.pdf
[5] ISO 15193 In vitro diagnostic systems--Measurement of quantities in samples of biological origin-Presentation of reference measurement procedures. ISO, Geneva, Switzerland(2002)
[6] Joint Committee for Traceability in Laboratory Medicine, PREAMBLE(2004).Website http://www.bipm.org
[7] Joint Committee for Traceability in Laboratory Medicine, Working Group I, Procedure Manua Websitehttp://www.bipm.org
以上材料如有侵权,请联系删除!

热门推荐
我要留言














