摘要
我国遗传代谢病筛查实验室众多,在仪器配置、检测方法、阳性切值、管理流程及质量控制等方面存在差异,不同实验室间的检测结果难以比较。为实现同质化管理,提高筛查质量,中华预防医学会出生缺陷预防与控制专业委员会新生儿遗传代谢病筛查学组和国家卫生健康委员会临床检验中心新生儿遗传代谢病筛查室间质评专业委员会,联合制定新生儿遗传代谢病筛查实验室检测技术规范共识,为全国筛查实验室提供质量管理标准,促进筛查技术的规范化应用。
新生儿遗传代谢病筛查是指在新生儿期对严重危害新生儿健康的先天性、遗传性疾病实施的专项检查,涉及多学科、多部门,由筛查管理、实验室检测、诊治随访三大部分组成[1, 2]。新生儿遗传代谢病筛查实验室检测分为检验前、检验中和检验后3个环节,参与的机构和人员较多,且各筛查实验室在仪器配置、检测方法、阳性切值、管理流程及质量控制等方面存在一定差异,不同实验室间的检测结果难以比较,迫切需要对筛查实验室检测流程进行规范,以实现不同地区间的同质化管理,切实提高筛查质量[3, 4]。为此,中华预防医学会出生缺陷预防与控制专业委员会新生儿遗传代谢病筛查学组和国家卫生健康委员会临床检验中心新生儿遗传代谢病筛查室间质评专业委员会组织专家,参考国内外最新文献及我国新生儿遗传代谢病筛查实践经验,制定了新生儿遗传代谢病筛查实验室技术规范共识,以督促各实验室加强质量管理,提供标准化的筛查服务,促进遗传代谢病筛查相关技术的规范应用。
本共识适用于承担新生儿高苯丙氨酸血症(hyperphenylalaninemia,HPA)、先天性甲状腺功能减退症(congenital hypothyroidism,CH)、先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH)、葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)缺乏症,以及使用串联质谱法对多种遗传代谢病进行筛查的新生儿遗传代谢病筛查中心。
筛查实验室的机构设置、组织架构与人员职责、检测流程请参见《新生儿遗传代谢病筛查组织管理及血片采集技术规范专家共识》[5]。其房屋和设备要求如下:
(一)房屋要求[6, 7]
1.HPA、CH、CAH及G6PD缺乏症筛查实验室用房2间以上,使用面积至少40平方米。
2.筛查中心开展串联质谱法进行多种遗传代谢病筛查,需根据仪器安装、运行的要求,增加相应的实验用房,使用面积至少20平方米,并合理布局。
3.综合用房2间,至少20平方米以上,用于滤纸干血片样本的验收、临床信息录入和资料登记保存。
4.储藏室或冷库(2~8℃)1间,用于滤纸干血片的保存;如长期(>5年)储存,建议在-20℃条件下保存滤纸干血片。
(二)设备要求[7]
根据筛查病种必需的检验项目配备相应设备,主要包括酶标仪或荧光分析仪1台,液相串联质谱分析系统1套,全自动荧光分析仪、洗板仪、振荡器、温箱或水浴箱各1台,计算机(包括打印机)3台,2~8℃冷藏柜2台,多通道加样器、单通道加样器各2支,氮气发生器1套,自动打孔仪或打孔器1台/5把,超净工作台和通风橱1台。若配备全自动荧光分析仪,可不配备洗板仪、振荡器、温箱或水浴箱。
(三)信息系统
建立与筛查病种对应检验项目配套的筛查信息管理系统,并制定实验室信息管理流程,确保信息安全,实现检验前、检验中和检验后的全流程管理[8, 9, 10]。
筛查实验室检测方法的选择应根据临床所需筛查病种、检测人员技术水平、场地等因素综合考虑。依据实验室使用的设备、试剂盒、检测指标的不同,制定合适的质控方案、规则、阳性切值及标准操作规程并严格遵守[11];对于原样本复测结果仍异常者,须召回重新采样复查,复查阳性者判为筛查阳性,筛查阳性患儿须追踪确诊。
(一)HPA
1.以滤纸干血片苯丙氨酸(phenylalanine,Phe)含量作为筛查指标。
2.Phe含量(浓度单位:μmol/L或mg/dl)阳性切值根据实验室及试剂盒确定,一般≥120 μmol/L(2 mg/dl)为筛查阳性。
3.筛查方法包括荧光分析法、定量酶法或串联质谱法。荧光分析法的结果受样本萃取时间、孵育温度和时间等影响,可通过全自动高通量分析,将检测过程中的萃取、加样和孵育自动化,提高实验的精确性。定量酶法具有检测方便、快捷、不受样品中的内源荧光成分和抗生素干扰等优点,但结果易受贮存温度和条件的影响,酶稀释液中含叠氮化钠,洗脱缓冲液中含三氯乙酸等腐蚀性试剂,需采取适当措施处理。利用串联质谱法筛查HPA时,除了检测Phe含量外,增加Phe与酪氨酸(tyrosine,Tyr)比值(Phe/Tyr)作为分析指标可提高检测准确度。根据2014版《高苯丙氨酸血症的诊治共识》[12],推荐串联质谱法作为HPA的实验室检测方法。
4.早产儿、未成熟儿、肝损害患儿可出现HPA假阳性,可通过肝功能检查、血尿代谢物质谱分析和基因分析进行鉴别;标本采集时若受检者蛋白质负荷不足,可出现假阴性,需定期体格检查和评估智能发育。
(二)CH
1.以滤纸干血片促甲状腺激素(thyrotropin,TSH)含量作为筛查指标。
2.TSH含量(浓度单位:μIU/ml)阳性切值根据实验室及试剂盒确定,一般为8~20 μIU/ml,高于切值为筛查阳性。
3.筛查方法包括荧光酶免疫分析法、酶联免疫吸附法或时间分辨免疫荧光分析法。荧光酶免疫分析法检测灵敏度高,达0.037 mIU/L,但易受试剂保存、孵育温度和时间等影响。酶联免疫吸附法检测的灵敏度为0.1 mIU/L,检测结果易受检测底物、标准品、质控品、待检测标本污染的影响。时间分辨免疫荧光分析法的检测灵敏度可达0.025 mU/L,纸片法为1 mU/L,因检测试剂易受污染,应现配现用,检测结果易受反应温度、EDTA螯合、试剂盒中示踪剂、缓冲液中叠氮化钠等影响。随着全自动设备在实验室的应用,时间分辨免疫荧光分析法已成为主流的检测方法。
4.新生儿TSH 出生后有生理性增高,血标本应在新生儿生后48~72 h充分哺乳后采集;低出生体重儿或极低出生体重儿可在生后2~4周或体重超过2 500 g时重新采血复查。
5.以TSH为筛查指标,可筛查因甲状腺缺如、萎缩或发育不良导致的原发性CH,对垂体或下丘脑功能低下引起的继发性CH或TSH延迟升高者可能出现假阴性,筛查漏诊率5%~10%,故对有疑问的样本,需重新采血送检,或直接进行甲状腺功能检测。
(三)CAH
1.以滤纸干血片17-羟孕酮(17-hydroxyprogesterone,17-OHP)含量作为筛查指标。
2.17-OHP含量(浓度单位:nmol/L)阳性切值根据实验室及试剂盒确定,正常分娩新生儿一般为10~40 nmol/L,高于切值为筛查阳性。因17-OHP含量受胎龄和出生体重影响较大,可建立不同胎龄和出生体重新生儿的阳性切值。足月儿和正常出生体重儿的阳性切值与早产儿和低出生体重儿阳性切值不同[13]。
3.筛查方法包括时间分辨免疫荧光分析法、酶联免疫吸附法或串联质谱法。时间分辨免疫荧光分析法为国内CAH筛查的主要方法,但其检测结果受Eu弃液污染、洗涤不完全、试剂保存不当、EDTA等影响。酶联免疫吸附法利用竞争免疫法测定17-OHP,其检测结果受孵育温度、时间和污染试剂等影响。串联质谱法具有灵敏度高、特异度强的特点,已成为CAH的二级筛查方法。
4.采用液相色谱-串联质谱法进行二级筛查时,可联合其他指标,如11-脱氧皮质醇、21-脱氧皮质醇、皮质醇,计算酶反应时的底物与产物肽段比值,筛查CAH亚型,有助于提高筛查的特异度及阳性预测值,降低假阳性率。
5.以17-OHP为筛查指标的目标疾病为经典型21-羟化酶缺乏导致的CAH。对其他亚型的筛查可利用串联质谱技术多指标联合筛查。
6.出生24~48 h内采血、应激反应、早产、低出生体重(肾上腺功能不成熟、酶活性较低)、危重疾病(如呼吸衰竭、败血症等)、黄疸、脱水及17-OHP阳性切值设定偏低等易导致CAH筛查结果假阳性,可在病情稳定后复查排除;孕母或新生儿糖皮质激素治疗史易导致CAH筛查假阴性,需在出生后2周复查;血17-OHP延迟升高等因素也可导致CAH筛查假阴性,筛查阴性及临床高度疑似者仍需进行诊断性实验。采用串联质谱法进行二级筛查,可提高筛查的特异度和灵敏度。
(四)G6PD缺乏症
1.以滤纸干血片G6PD活性作为筛查指标。
2.G6PD活性(单位:U/gHb或U/dl)的阳性切值根据实验室、试剂盒及方法学确定,因季节和地域不同而有差异。夏季易受温度影响造成假阳性。一般为2.0~2.6 U/gHb或15~30 U/dl,低于切值为筛查阳性。
3.筛查方法包括荧光定量法和定性荧光斑点法[14]。荧光定量法具有灵敏度高、实验程序和操作步骤简便、耗时少、结果客观易判别且费用低廉等优点,但也存在女性杂合子检出率低,检测结果易受血斑质量、实验取样部位、样本储存时间、温度、湿度等因素影响的问题。荧光斑点试验的检测准确度较高,特别是对于G6PD重度缺乏者(男性半合子和女性纯合子)的检出率近100%,但其结果的判断受主观因素影响较大,点样圆斑的大小可影响荧光强弱的分辨,结果不能长期保存,不适用于血红蛋白<60 g/L的患儿,现较少应用。
4.以G6PD活性为筛查指标对女性杂合子不敏感,易出现假阴性,需结合基因检测明确诊断。G6PD活性检测结果易受血片采集、递送时间、温度和湿度、标本保存条件等影响而出现假阳性,夏季运输过程中血片需保持低温,建议血片采集后1周内检测。
(五)串联质谱法筛查多种遗传代谢病
串联质谱法筛查多种遗传代谢病的检测指标为血游离肉碱、多种氨基酸及酰基肉碱,检测原理见HPA筛查(串联质谱法)[15, 16, 17]。对所检测的样本分析物先进行离子化处理,再对特定的质荷比(m/z)进行检测,得到不同峰高、峰面积的质谱图,根据被检测物质对应的内标离子强度和已知浓度,实现对目标化合物的定性及定量检测。
1.样本前处理:串联质谱样本前处理方法分为衍生化法和非衍生化法。衍生化法主要是将难以分析的物质转化为与其化学结构相似但易于分析的物质,便于量化和分离,通过氨基酸、游离肉碱及酰基肉碱的羧基与盐酸正丁醇进行酯化反应实现。大多数氨基酸丁酯化后在串联质谱碰撞室生成质荷比为102的碎片离子,酰基肉碱丁酯化后在碰撞室生成质荷比为85.1的碎片离子。利用此特性,质谱仪采用中性粒子丢失、母离子扫描和多反应监测等模式对质量数为85.1和102的特征离子进行扫描,即可对多种肉碱和氨基酸进行定性分析,与同时处理的已知浓度同位素内标进行比较即可实现目标物的定量分析[18]。
质谱峰强度与其对应的化合物含量呈正比,通过比较测定峰与相应内标峰的离子强度,可进行定量分析。串联质谱定量分析软件根据样品中氨基酸及酰基肉碱与其对应的同位素内标离子峰强度(内标浓度已知),自动计算出待测物的浓度,公式为样品浓度=样品离子强度×萃取液体积×内标浓度/干血片中的含血量×内标离子强度×RRF,其中RRF为校正系数。
在衍生化法操作中应注意,试剂开封后稳定时间短、塑料容器会溶解到样本中影响结果,萃取步骤中使用的热封膜必须全覆盖与密闭,以减少挥发;盐酸正丁醇具有强腐蚀性,必须在通风橱中进行氮气吹干,确保样品完全干燥,同时避免对环境及人体的危害。
非衍生化方法处理的样品由于没有丁酯化,氨基酸、酰基肉碱经过碰撞室时不能共同丢失或产生相同的碎片离子,故所有氨基酸、游离肉碱及酰基肉碱均采用多反应监测扫描方式。非衍生化方法虽然会降低一定灵敏度,但其前处理操作时间短、环境污染低,已在筛查实验室广泛普及。
2.串联质谱法筛查病种:根据患病率、检测灵敏度和特异度、病种选择原则,以及国内串联质谱法筛查遗传代谢病现状,可首选17种疾病作为我国新生儿遗传代谢病筛查的目标疾病,每种疾病对应的基本检测指标见表1。筛查病种可以根据各地区的医疗资源、需求、疾病发生率等实际情况适当增加。
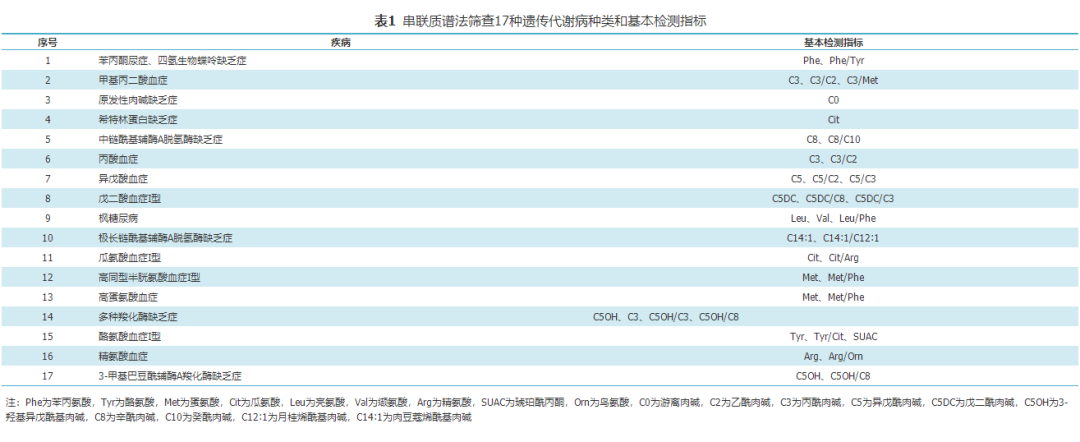
3.检测指标设置:应参照表1内容并结合试剂盒说明书进行设置,可增加指标的比值,以提高检测的灵敏度和特异度。检测指标浓度及比值的阳性切值根据各实验室及使用的试剂盒确定。针对不同时期新生儿所采集的标本,可设立不同分组,分别建立检测指标的阳性切值。
4.检测过程监控:检测过程中应进行仪器状态和运行过程监控。进样前对进样管道和离子源喷雾针进行冲洗;质谱数据采集过程中,要监测液相泵的压力、温度、气体压力、质谱真空度、色谱图总离子流峰型、离子强度;数据采集结束后对进样管道和离子源喷雾针进行再次冲洗。
筛查实验室拟开展新的检测项目时,应对所开展项目的检测方法进行方法学评价,明确所使用的仪器设备、试剂性能验证的程序、定期校准程序和定期维护程序。
方法学评价的内容包括检测方法的灵敏度、特异度、检测限、生物参考区间、可报告范围及干扰物质等。
首次使用商品化试剂盒的检测项目时应进行方法学验证,验证内容主要包括方法的灵敏度、特异度与参考区间等。当检测仪器、前处理方法、样本类型、测试程序发生变化时,需再次进行方法学的验证。
(一)结果解释
1.结果解释应基于特定疾病关键生物标志物的检测值和已建立的切值。
2.对于原样本复测后结果仍异常者,判为筛查阳性,须追踪、确诊和治疗[19, 20]。
3.结果解释还应考虑到新生儿在采集样本时的日龄、营养状况、输血情况、出生体重或采样时的体重、胎龄及其他因素(如标本状况)。
4.串联质谱法可同时检测数十种分析物,发现多种遗传代谢病。但一些遗传代谢病受早期检测指标灵敏度和特异度、病理机制(如X连锁遗传病)与个体差异等因素影响,新生儿期的检测可能存在假阴性的风险[21]。
(二)结果报告
结果报告无论是阴性或阳性,都需要符合一般标准,除常规的姓名、出生日期、性别、送检单位、标本采集日期、标本验收日期、测试日期、报告发布日期、实验室名称、地址及联系方式、实验操作分析人员及审核人员等常规标识外,重点应包括检测指标定量检测值、筛查结论与建议。
1.实验室须在接到标本5个工作日内进行检测,结果可通过信息系统及时反馈给监护人,对可疑阳性患儿要出具报告,并及时召回。
2.每月向开展新生儿遗传代谢病筛查血片采集的机构或助产机构反馈实验室检测结果,阳性检测结果应及时反馈。
3.实验室应制定切实可行的质控程序,选择合适的质控规则,并在日常实验中参照执行,以监控潜在的系统误差和随机误差[22]。
4.每月召开实验室质控会议,针对实验室质量指标和国家卫生健康委员会临床检验中心反馈信息的统计结果进行分析讨论。
5.每年参加国家卫生健康委员会临床检验中心新生儿遗传代谢病筛查实验室室间质量评价,并且成绩合格[23]。
6.有完整的实验室检测信息资料和严格的信息安全保障措施,信息资料存档保留至少10年。
7.在实验室内部,应根据自身实际情况定期分析以下指标,监测检测质量[24]。包括:(1)检验前的新生儿遗传代谢病健康教育知晓率、检测血片不合格率和接到标本5个工作日内检测率;(2)检验中的室内质控开展率、变异系数不合格率、室间质评参加率;(3)检验后的初筛阳性召回率、召回阳性率、检测病种发病率。
8.实验室应定期进行仪器校准,试剂更换批次时进行性能验证,以保证检测平台稳定、受控,检测结果可靠。
随着遗传代谢病筛查病种的增多以及质谱法筛查多种遗传代谢病对技术人员专业要求的提高,新生儿遗传代谢病筛查在检测质量控制、不同实验室间检测结果可比性等方面将面临更多挑战。本共识在4种传统遗传代谢病筛查的基础上,针对多种遗传代谢病筛查的仪器配置、检测方法、阳性切值、管理流程及质量控制等,制定了新生儿遗传代谢病筛查实验室检测技术规范,为全国筛查实验室提供了同质化的质量管理标准,以促进筛查技术的规范化应用。
引用本文
中华预防医学会出生缺陷预防与控制专业委员会新生儿遗传代谢病筛查学组, 国家卫生健康委员会临床检验中心新生儿遗传代谢病筛查室间质评专业委员会. 新生儿遗传代谢病筛查实验室检测技术规范专家共识 [J] . 中华新生儿科杂志(中英文), 2023, 38(8) : 449-454. DOI: 10.3760/cma.j.issn.2096-2932.2023.08.001.














