10月8日,我们翻译并发布了大分子检测指南 | CLSI C64:蛋白质和肽类的质谱定量第一章,本期为第四章下,文章底部附有往期内容链接,欢迎感兴趣的同道查看。

第四章:工作流程和仪器
章节要点
• 完整或蛋白质水解辅助分析的分析策略
• 基于分析物特性、期望的定量限和测量技术选择的工作流程
• 关于多电荷蛋白质及肽前体离子和经典小分子之间差异的细节内容
4.2 仪器
单一的质谱仪不会满足所有分析。每种类型的仪器都有其自身的性能特点和权衡。尽管仪器种类繁多,但蛋白质和肽定量分析严重依赖于高效液相色谱(HPLC)、电喷雾电离(ESI)和三种分析器类型(即四极杆、静电场轨道阱、以及飞行时间)。仪器和技术,如基质辅助激光解吸飞行时间质谱(MALDI-TOF)和离子淌度应用正在迅速发展,但在本指南中未涉及。
4.2.1 液相色谱
LC指的是在质谱分析前对多组分混合物进行液相分离。LC系统通常直接与质谱仪接口。在蛋白质和肽分离过程中,色谱系统的液体流出物经常与ESI兼容,使得在色谱图生成过程中实时检测离子化分子成为可能。
色谱分离相关的产品很普遍。然而,反相分离被广泛用于分离蛋白质和肽,尤其是与质谱联用时特别有用。反相色谱根据分析物的表面疏水性进行高分辨率的分离,这高度依赖于氨基酸组成,具有保守的单一氨基酸差异的多肽通常可以被分离。分离系统使用疏水固定相(例如,烷基改性硅胶)和泵送的流动相,其中溶剂强度通常随时间增加(例如,水与逐渐增加比例的甲醇或醋酸盐混合)。检测开发者可以通过仔细优化许多参数(如固定相组成、柱长、颗粒大小、温度、流动相流速和流动相组成变化速率)来实现高分辨率分离。此外,可以同时(即混合模式分离)或顺序(即多维分离)使用多种色谱模式。
4.2.2 电喷雾电离和多电荷
ESI是一种过程,其中液体在高电场下被输送到质谱仪的源区域,最终形成带电的分析物分子(即离子)。ESI通常直接与LC联用,因为这样可以方便地将液体转化为气溶胶并产生气相离子。几乎所有可通过色谱分离的蛋白质或肽都可以使用ESI进行电离。ESI的主要缺点是其对干扰敏感,通常表现为电离抑制或增强。在任何时间点产生的分析物离子的响应可能会受到其他共洗脱的样品成分的影响,包括其他肽、脂质、碳水化合物或盐。这些干扰可以显著改变测量的灵敏度和动态范围。
蛋白质和肽ESI的一个特点是形成一系列多电荷离子,而不是单电荷离子,单电荷离子在小分子中几乎无处不在。蛋白质的电离(通常也是肽的电离)根据其大小和氨基酸组成会产生每个分子种类的电荷态分布(例如,3+、4+、5+、6+)(见图5)。通常,电荷态的数量随着分子量的增加而增加。多电荷的优势在于它将高分子量蛋白质和肽的m/z降低到大多数现代质量分析器的可检测m/z范围内。然而,多重带电有两个缺点,首先,它降低了m/z域内一个分布的同位素的间距,从而增加了在干扰存在情况下选择性检测的分辨率负担。其次,多重带电也降低了分析物的有效信号,从而限制了分析灵敏度。
4.2.3 质量分析器
离子在源中形成并被吸入质谱仪后,质量分析被执行。将QQQ分析器应用于肽分析与其在小分子分析中的使用是类似的。因此,CLSI文件C50和C62中讨论的描述和关键变量也适用于本指南。直接分析完整蛋白质通常需要使用高质量精度分析器。高分子量蛋白质通常使用飞行时间(TOF)或静电场轨道阱质量分析器进行测量。TOF质谱仪在CLSI C50文件中有描述。然而,静电场轨道阱质量分析器最近才商品化,其在医疗实验室的使用才刚刚开始。
完整蛋白质质谱定量的选择性主要取决于质谱仪的分辨率,如公式(1)所示。
分析物的m/z / 离子间m/z的差异 = 分辨率要求 (1)
比如用公式(1),分辨率为100000(500/0.005=100000)时,m/z为500的等丰度离子在质量差异0.005Da时可以被区分,相比之下,m/z 2500的等丰度离子在质量差异至少0.025Da时才可以被分离。因此,更高分辨的质谱仪对于除小蛋白之外的其它高特异性分析都是必需的。对于常规的临床诊断,单个蛋白质形式的完整分析通常需要使用最高分辨率(即半峰全宽[FWHM]为100000)的仪器,比如静电场轨道阱和飞行时间质谱仪且限于30kDa以下的蛋白质。一般而言,更低分辨率质谱仪可分析分子量更大的完整蛋白,但是方法必须被设计以具有足够特异性和灵敏度。此外,方法也依赖于丰度以满足性能要求。
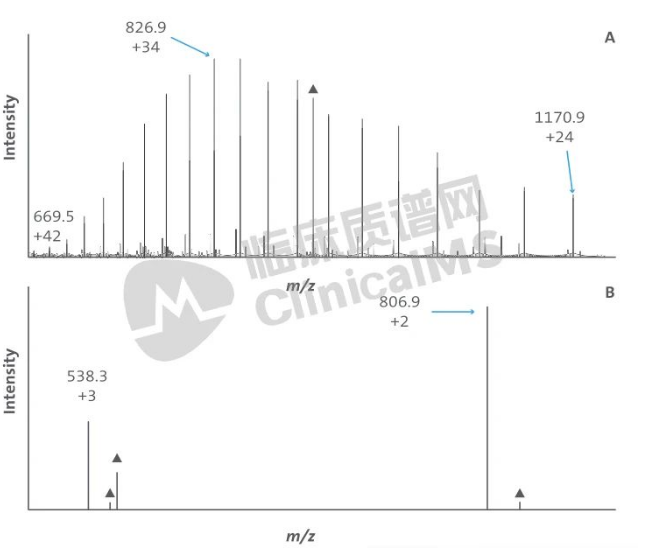
图5 蛋白质和肽带多重电荷的例子。(A)apoA-1的+24至42的带电状态。(B)apo-A1 胰蛋白酶水解肽LLDNWDSVTSTFSK的+2和+3的带电状态。▲代表杂峰。
4.2.3.1 低分辨率:三重四极杆
医学实验室最常见的质量分析器组合是三重四极杆(QQQ)。这种仪器由两个低分辨率质量分析器(即,全宽半高(FWHM)≤3000)组成,它们排列成一行并通过一个四极杆碰撞池分隔。对前体离子和该前体的一个或多个选定产物离子进行MS/MS分析具有高度的选择性。与CLSI文件C62中描述的小分子检测程序类似,QQQ在选择反应监测(SRM)模式下定量具有高度灵敏度和选择性。
除了生物基质中丰度最高的蛋白,MS/MS通常没有足够的选择性来区分消化样本中的代理肽与干扰肽。用于临床测试的典型样本(如血浆、血清、尿液、脑脊液)非常复杂,大多数分析需要进行富集和/或色谱分离。LC-MS/MS定量分析一维色谱分离消化后的血浆或血清的测量下限(LLMI)在50-100 ng/ml范围。LLMI受限是由于消化后样本复杂性增加,样本基质中的蛋白产生了许多潜在干扰肽段。优化的富集和色谱分离方法通常可将LLMI提高50-100倍。
4.2.3.2 高分辨率:静电场轨道离子阱和飞行时间反射器
医学实验室越来越多地使用高分辨率质量分析器进行定量分析。这些分析器具的特点是具有卓越的分辨率(即,全宽半高(FWHM) > 20,000)以及低ppm质量准确度。它们可以以混合配置排列,其中一个四极杆和碰撞池置于高分辨率质谱仪前方。这种配置使前体离子的选择和产物离子的高分辨率分析成为可能。从产物离子谱生成的提取离子色谱图产生了类似于QQQ产生的前体-产物离子色谱图。这种技术称为平行反应监测(PRM),可以通过高分辨率检测产物离子来解决共洗脱的同质异位素干扰问题,这些干扰在低分辨率四极杆中无法区分。蛋白消化领域存在挑战,因为许多肽段共享前体和产物离子质量。PRM在选择性方面优于基于QQQ的SRM检测。然而,PRM并非总是有益的,因为高分辨率仪器中的检测器(例如,飞行时间、静电场轨道阱)本质上比QQQ中使用的电子倍增器灵敏度低。这类仪器的性能特征正在快速发展。
为了收集同位素分辨率高的、高电荷态蛋白谱图,高分辨率和高质量准确度是完整蛋白分析所必需的。在这些情况下,通过选择窄质量窗口范围来生成提取离子色谱图,以实现定量分析的分析选择性。高分辨率使得复合蛋白型检测成为可能。然而,完整蛋白分析物的质谱图受到直接分析物的质量、电荷状态、蛋白型数量和仪器性能特征(即,分辨率和 duty cycle)的限制。目前的仪器可兼容大约30kDa的蛋白质。














