10月8日,我们翻译并发布了大分子检测指南 | CLSI C64:蛋白质和肽类的质谱定量第一章,本期为第五章下,文章底部附有往期内容链接,欢迎感兴趣的同道查看。

第五章:内标
本章包括:
• lS在蛋白质和肽工作流程中的重要作用的
• 选择合适的IS时考虑的关键因素
• 关于可以用不同类型的IS控制的加法顺序和错误来源的建议
• IS的来源、制造过程和质量要求的描述
5.3 内标的有效使用
样品处理要求决定了蛋白质/肽段LC-MS方法的内标(IS)选择。图7概述了蛋白酶辅助LC-MS/MS测定中包含的步骤,许多步骤(例如,富集、分离、电离、检测)与小分子分析的步骤相似,其他步骤则是使用特征性肽段进行蛋白质定量独有的(例如,去氮、烷基化、消化),这些步骤也增加了产生误差的可能性。样本和校准品之间富集过程中回收率的差异、消化效率的差异以及基质效应的差异会导致不同的响应因子,这些误差可通过有效的IS进行校正。随着误差可能性增加,IS对于校正这些误差至关重要。但IS无法校正由错误定义的蛋白形式、缺乏互通性的校准品或样本提取前的处理过程中的问题而引起的校准错误。
对于生物样品的蛋白质MS定量,最佳的IS是折叠正确的同位素标记的全长蛋白质,它将与基质中的天然蛋白质经历相同的生物学相互作用。如果这种IS在一开始的样品处理步骤中添加,它将控制检测中所有潜在误差,因为它在结构和生化上等同于天然蛋白质。使用与天然蛋白质相似的IS对于完整蛋白形式的MS定量方式很有价值,因为蛋白质直接被富集和检测。然而这种高质量蛋白质IS不太可能对任何临床相关蛋白质都具备,可用的SIL IS蛋白质可能可以完美模拟某些蛋白形式但只能作为其他蛋白形式的类似物。
在大多数定量工作流程中,物理和化学方法在减少蛋白质四级和三级结构对消化的影响方面起着关键的作用。化学或热变性方法通过破坏蛋白质四级结构和三级结构而加速消化动力学,消化过程也能破坏蛋白质的四级、三级和二级结构。在结构特征对于精确定量不重要时,这些步骤方便了IS的使用。
方法开发周期(在第7章中描述)包括评估和优化样品制备和富集方法的研究。这些研究通常包括针对一个蛋白质使用不同的IS。图7描绘了使用各种IS形式进行蛋白质酶解辅助检测的大体工作流程,同时展示了不同IS加入体系的时间点及其能校正的误差来源。
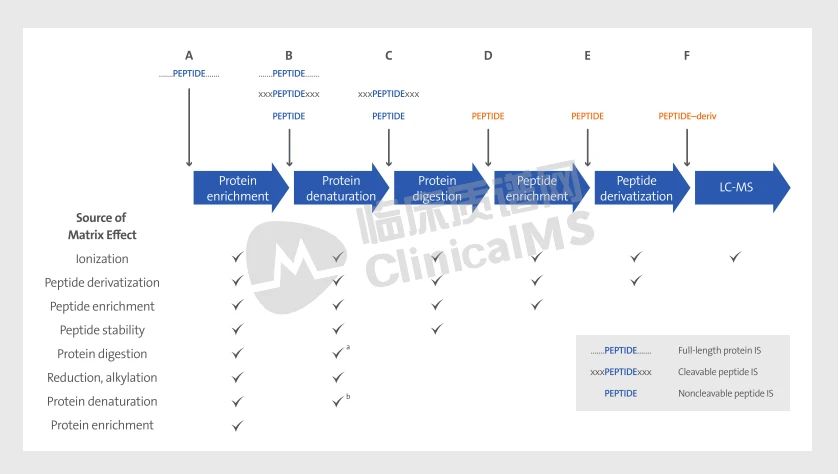
缩写:IS,internal standards(内标);LC-MS,liquid chromatography-mass spectrometry(液相色谱质谱法)。a 只有全长蛋白和可裂解肽段可以控制消化。b只有全长蛋白可以控制变性。
图7 蛋白酶解辅助的蛋白质检测常规工作流程(不同类型内标的使用、引入反应体系的时间点)。在不同节点引入内标可以控制的分析误差来源用√表示。内标在工作流程后半部分加入(橙色字体)相比于用作分析IS能更好用于质量保证。
在一个工作流程中回收率有许多变异来源。为了精确指出变异来源,通常使用多种IS来覆盖分析过程质量控制的需求。本子章节描述了图7中展示的过程。
使用同位素标记的可裂解肽段作为IS,将其在步骤B中加入反应体系。该肽段(XXX PEPTIDEXXX)包括与分析物相同的侧翼氨基酸(PEPTIDE的每一侧为XXX)。消化过程将PEPTIDE从天然蛋白质和PEPTIDE IS中释放(步骤C),在步骤B添加可裂解肽段IS能使我们比较消化到电离之间所有过程的一致性。第二个IS(PEPTIDE),一个不同程度同位素标记的不可裂解肽段,在步骤E添加IS可使我们比较样本和标准品间衍生和电离的一致性。在实践中,如果在步骤B添加的IS响应减少而在步骤E添加的IS没有变化,则表明在蛋白质变性、消化和/或肽段富集过程中(发生在步骤B和E之间)存在基质或回收率偏差。
用于蛋白质的分离或富集不太可能对相应的IS特征性肽段有效。因此,可裂解和不可裂解肽段IS都不可能校正蛋白质富集的误差(步骤A)。只有更高级的蛋白质IS才能控制这个过程。
方法开发者应仔细考虑是在变性(步骤B)之前还是之后添加IS肽。在变性后添加IS肽能控制样本和校准品间后续移液过程中的变异、吸附损失的差异、化学修饰、降解或基质效应。相比之下,使用可裂解肽段IS可能要求蛋白质被变性以便被充分消化,因此需要更早地添加IS(步骤B)。
不可裂解肽段IS不能控制天然蛋白质的消化过程,但可以控制消化过程形成的特征性肽段的降解。特征性肽段在释放后可能由于肽段沉淀或聚集、非特异性蛋白酶解、化学修饰和吸附等因素而被降解。如果一个不稳定的特征性肽段从天然蛋白质中释放,那么在消化后(步骤D)添加IS并不能监测降解的变异和降低误差。实验室可以通过严格控制消化过程(例如,孵育时间、温度、pH值、混合方法、添加的胰蛋白酶量)来克服这个限制。然而,控制消化并不能纠正基质依赖性的变异。因此,建议在消化试剂(步骤B或C)之前(或同时)添加肽段IS。二级IS校正的额外示例包括在消化前(步骤A至C)和消化后(步骤D)添加IS,以及使用不同标记的胰蛋白酶肽段校正特征性肽段和可裂解肽段的回收。
通常伴随蛋白变性的半胱氨酸还原和随后的烷基化有时也是需要的。由于对烷基化效率的担忧和简化工作流程的考虑,通常会避免使用含有半胱氨酸的特征性肽段。然而,还原和烷基化过程可以提高不含半胱氨酸的肽段的产量,这是消化过程中的重要现象。确定最优的IS以控制烷基化效率或监测非特异性烷基化有待探索。这些基本概念适用于方法使用的任何类型的衍生化。
IS对于方法开发过程中的性能评估很有价值,同时也用于批次质量保证。例如,当等量IS被添加到每个样品和校准品中时,应该在一批中观测到IS一致的回收率(即,IS峰面积的变异系数<30%,理想情况下<10%)(参见CLSI文件C62A)。
方法开发者需要考虑肽段的化学纯度,同位素标记纯度、质量差异以及储存条件。
5.5.1 化学纯度
不同商业来源的合成肽段的质量有很大差异。为了保证质量,实验室应从制造并提供分析证书的供应商那里购买合成肽段,而不是从没有质量信息的经销商那里购买。尽管供应商的证书很有用,但实验室应验证所有物质,没有纯化或低度纯化以及没有表征的粗肽不应在临床测定中使用。
为了确保临床测定对批次变化的稳健性,制造商应表征IS肽段的净含量、纯度和确切组成,净含量和氨基酸组成需要使用性能被验证的氨基酸分析(AAA)确定。质量检测实验室应使用国家标准和技术研究所的标准和参考物质(RMs)。用于AAA的肽段水解条件应针对每个肽段进行验证以获得最佳的定量准确性。紫外检测器在214 nm、220 nm和/或280 nm处可用于确定纯度以及检测可能干扰测定的肽段合成副产物。典型的目标纯度为>95%。LC-UV中检测到的主要峰应使用MS进行分析,通过全扫描MS谱进行质量测定和从产物离子谱进行序列确认,从而确认产品质量。
从细胞裂解物中纯化的重组蛋白同样需要进行表征。目标纯度通常为>90%。与肽段相比,这种略低的目标纯度反映了蛋白质生产和纯化的技术挑战。净含量、氨基酸组成和纯度表征与肽段类似。然而,蛋白质表征还可能包括聚丙烯酰胺凝胶电泳及二磺酸基三苯甲烷或银染色。凝胶分析提供了蛋白质同质性和质量的正交评估,也可提供蛋白纯度的估计(这是LC-MS分析不具备的)。为了将观察到的质量与理论质量进行比较,最好是通过对多重带电离子的MS谱去卷积来确定完整蛋白质的质量。建议对蛋白质的胰蛋白酶消化产物进行数据依赖的LC-MS/MS分析以验证目标蛋白质和污染蛋白质的身份。对于在完整蛋白形式定量工作流程中使用的IS蛋白质,方法开发者还应进行结构和功能研究,如活性或配体结合的测定。IS蛋白质和肽段的表征水平应根据测定要求进行调整。表征应足够可靠,即IS蛋白质和肽段符合已建立的标准,可以在测定中使用而不引入干扰。
5.5.2 同位素纯度和质量差
标记蛋白质或肽段的同位素富集指的是重同位素替换轻同位素的程度。SIL氨基酸可用来合成SIL蛋白质和肽段。13C和15N是标记氨基酸最常用的稳定重同位素,分别提供了0.9927 Da或0.9970 Da的质量增加,它们可以被纳入到特定的原子位置或者纳入到所有位置。许多特定位置标记的氨基酸已被商品化。然而,用13C和15N替换所有的12C和14N以生成标记肽段是最常见的。碳和氮的氨基酸同位素纯度标准通常为≥99%。一般避免使用氘标记,因为氘代置换增加了碳-氘键的长度和分子体积,足以引起色谱保留时间的偏移。在肽段水平,同位素富集度取决于氨基酸组分的数量和特定同位素富集,但通常要求>96%。
在任何特征性肽段中加入标记的氨基酸应该提供相对于双电荷前体至少6 Da(相对于未标记肽段)的质量差异,对于三电荷则是8-10 Da。这些质量差异足够大可以排除来自天然和标记肽段的同位素覆盖的重叠,并且可以通过在合成过程中使用常见的15N和/或13C标记的氨基酸进行单一或双重取代轻松实现(见表4)。质量差异不足可能会因为未标记分析物对标记IS的贡献而导致分析物的定量不准确(见图8)。
重组表达的蛋白质可以用13C和/或15N进行同位素标记,其富集度经常超过95%。标记和未标记原子在蛋白质中的随机分布可能使得标记同位素对分析用途的足够性的评估变得复杂。因此,标记效率随蛋白质大小的增加而变化,需要被评估。SILAC程序同样高效,但在生产过程中必须注意以确保体内的氨基酸不会降低标记效率。应通过评估完整质量测量和/或测定特征性肽段的富集来评估富集水平。高分辨率全扫描LC-MS数据对全面描述富集适宜性特别有用。
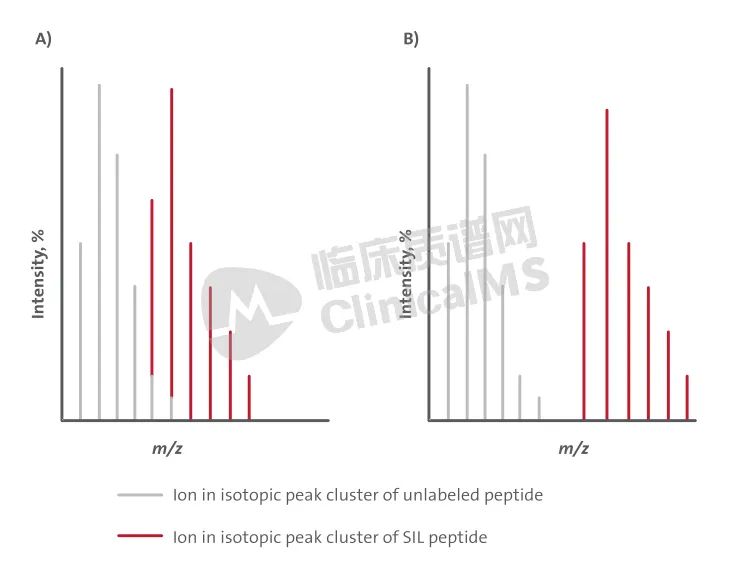
缩写:SIL (stable isotope-labeled),稳定同位素标记。
5.5.3 储存稳定性
供应商通常以冻干形式提供肽段,偶尔也以溶液形式提供。冻干肽段重构浓度一般比最终工作浓度高10到1000倍。由于湿润的固体表面结合能力有限,低浓度时非特异性吸附造成的肽段相对损失要大于在高浓度溶液中的损失。肽段的溶解度取决于氨基酸序列。富含天冬氨酸和谷氨酸残基的酸性肽段易溶于碱性溶液,而富含组氨酸、赖氨酸和精氨酸残基的碱性肽段易溶于酸性溶液。可以使用强有机溶剂如乙腈、二甲基甲酰胺或二甲基亚砜有效溶解含有较高比例疏水残基(例如,> 50% 丙氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、苯丙氨酸、色氨酸、脯氨酸)的肽段。对于含有碱性N端和C端氨基酸的胰蛋白酶消化后的肽段,通用溶剂是5%乙腈水,添加0.1%-1.0%的甲酸。
干燥纯化的肽段应在4°C下稳定保存30天以上,-20°C下保存三年。此外,肽段应在冻干和复溶过程保持稳定。在使用寿命期间肽段随时间推移的损失应小于3%。在溶解和储存过程中,最小化肽段的回收率变异是非常重要的。移液吸头、自动进样器样品瓶和肽段储存容器可非特异性吸附肽段从而导致损失或携带污染,并增加后续定量的变异性。通常,聚丙烯储存瓶比玻璃瓶更适合。然而,读者应当注意,本子章节中的推荐并不构成方法验证接受标准,IS肽段溶液的储存和稳定性条件应当被证明满足其预期用途。














