质控在路上—— 冯仁丰教授谈怎样做检验
发布日期:2019-10-21 来源:临床实验室 临床质谱网 浏览数:4829 人
近年来,随着临床医疗水平的不断提升,中国的检验医学事业也快速成长,临床检验结果已成为医务工作者对患者疾病作出正确诊断和及时治疗的重要依据,检验结果准确与否甚至与患者性命息息相关。如今实验室进入了自动化时代,如何运用自动化仪器提供一份精准的检验报告,成为了检验人员面临的新挑战。本期《临床实验室》对话栏目,诚邀我国检验医学领域的著名专家冯仁丰教授同大家分享怎样做好检验。
冯仁丰教授:我认为怎样做检验的第一个要求是做一个好人,你我大家都是做检验的同行,做了那么多年的检验,怎么还要讲“怎样做检验”?理由很简单,做检验,首先要做一个好人!做一个有良心的人!做一个有事业心的人!做一个对得起老百姓的人!才能做出有质量的结果!没有这样的前提,检验做得再多,你只是糊涂过日子!乱出报告,不但病人的钱白花!甚至会危害病人的及时诊断和治疗!
平时,我们的实验室人员说,我们有QC!就是有QC,还有许多问题!你能做QC,说明实验室有了质量概念!但是,你真的理解了质量了吗?每天的QC在控,实验室都认为我们的质量很好!真的是这样吗?我估计有很多问题!按照正态分布的规律,一个QC检测结果被认为在控,是说:它的结果有95%的可能性在 之内。走遍世界,任何临床实验室都知道!可是,再认真想一想,如果每天发出100个相同检测项目的检测结果中,会有5个结果也许已经出了问题!它不在所谓的 范围之内!属于有质量问题的结果被发给了病人和临床!可是临床医生会依据这样的检测结果,对病人做出了诊断和非常不当的治疗!后果是,这样的病人也许就死在ICU病房!或者在家里!就是没有死在实验室门前!可是实验室出具这个结果的人员,丝毫没有感觉;因为我们的结果是在控的!如果这样的病人是你的亲人,你也许会对检测结果有疑问,转而再采样、再检验!做一次不行,要多做几次!还必须与主管医师反复联系!直至做出正确诊断和治疗。你的家属得救了!你感到自己对得起亲人来了!
冯仁丰教授:我一直难以忘怀Dr Westgard第一次来我国介绍Westgard多规则时,我为他做翻译。当时,他使用了家庭的照片,他指着照片说,他有一个非常可爱的孙女。这次,她也跟着他来到中国,不巧她生病了,儿科医师为她检查后,要求为她进行血液常规检验。
他说:“这是我的孙女! 任何人要对她进行检测,你必须得做准确!”他知道,那个医院的检验科,因为是他的孙女,非常认真地进行了检验。包括分析前的采集样品和检测中的质量控制。在发出报告前,还即刻与儿科医师联系,询问病人。知道临床观察和检测结果基本一致下,发出了检测报告,Dr Westgard非常满意。这时候Dr Westgard说,检验科人员对自己家庭成员的检测也应该准确! 因为这是你的亲人!然后,他又说,你们是否面对在科室外等候检测报告的所有病人,也像对待我的孙女那样,认真负责地做好每个检验?我们只有对每个检验都正确地操作,才能实现质量要求!
Dr Westgard与她孙女的合影,充分展现了他对孙女的爱,而孙女坐在他身上,满脸笑容。这是一张充满爱的照片。可是,Dr Westgard指着照片上的他说,假如这不是我,是你,是一个检验人员;我的孙女是接受你检验的病人。你是否也像我爱孙女那样地对待每个接受检验的病人?他说得太好了!我们的实验室人员,一定要像Dr Westgard说的那样,要深深地爱着每个接受我们检验的所有病人!只有对他们充满了爱,我们的检验才会做得好!
因此,怎样做检验的第一个事,我在到处呼吁:“我们临床实验室的每位工作人员,必须要对所有前来被要求做检验的病人,将他们视为自己的亲人!去认真做好每一个检验结果!” 没有这个前提,检验等于白做!甚至在害人! 这就是做人的道德!做人的基本要求!这是怎样做检验的的第一个要求!习近平主席的“平语近人”要好好学习,认真思索。“三严三实”是我们天天要面对的要求,大家要时时铭记、事事坚持、处处上心,随时准备坚持真理、随时准备修正错误,凡是有利于党和人民事业的,就坚决干、加油干、一刻不停歇地干;凡是不利于党和人民事业的,就坚决改、彻底改、一刻不耽误地改。“既严以修身、严以用权、严以律己,又谋事要实、创业要实、做人要实”的要求。让我们一起去认真考虑,我们应该怎样去面对自己的服务对象——病人!
冯仁丰教授:我前面说过怎样做检验的第一个要求是做一个好人,第二个需要认真考虑的是:我们是懂了怎么做检验了吗?在临床实验室第一线工作的同道在学校里学的就是临床检验,怎么会不懂?如果,你只知道一个检验项目在什么仪器上检验,只要样品上仪器,检验就会自动进行。至于每个项目的检测原理、它的分析性能、如何进行校准、有什么容易出现的问题?出现问题应该如何去寻找和排除?都认为与我们没有关系,有问题找试剂或仪器厂商,让他们来解决!解决不了换一家!你多精明呀!!!检验报告是你出的!可惜你连检验是怎么做出来的基本要求都不懂,有问题找厂商!那么,主任为什么还要你在这个岗位上?只要找一个听话、不乱来的人,随便哪个人都可以操作的话,你将没有饭吃了!检验难道就这样不值钱?说明,今天的实验室人员已经“堕落”到如此地步!扪心自问:你是这样的人吗?
今天的实验室,除了临床检验还有些需要手工操作(还有微生物)外,几乎都是自动化了。 但是,千万不要忘记,自动化的检验能够出符合临床要求的结果吗?需要理解和精通很多内容,要做好检验的必备业务要求,还有许多问题需要你回答的。例如,什么是每个检测项目的分析性能?为什么永远要将检测的精密度放在检验结果的第一位?什么是检测系统?如何确保检测系统的完整?每个定量分析性能的含义是什么?如何确认和验证?换用不同批号试剂时,我们应该做什么?不同实验室间相同项目的检测结果的比对,应该怎样做?相关和回归统计说明了什么?开展质量控制的要求?如何看控制结果?如何判断结果是否在控?失控应该怎么做?每个控制规则的含义和理解?发现地区内实验室室间比对差距很大,如何去纠正问题?是否精通每个检验项目的反应原理和操作程序?实验室是否具有真正的操作规范?是自己按照实际操作写的?还是照抄产品说明书?换用不同厂商产品后,应该做什么?你做了吗?自己或家里亲人生病后,迫切需要某些检验项目确诊下,你是否考虑到其他医院去做化验?或者请别人给你再做几个,了解差距?
以上说到的,是全国的通病!越往下走,看到的问题越多!非常害人!因此,凡事要从自己做起!我再三呼吁,每一位检验同道一定要做一个对得起老百姓的人!不仅从良心上是这样,而且在具体检验中,有扎实的技术基础,而且有过硬的操作能力,还有不断学习和提高业务的努力,你才是一个符合要求的检验人员!
冯仁丰教授:临床实验室检验的最突出“特色”是临床实验室对每个病人样品需要检验的每个分析物项目,均只做一次就发出报告。这只是一个统计上的一个抽样!连均值都不如!因此,临床实验室在质量上首先要实现精密度,也即控制不精密度是第一位的大事!临床对实验室出示的病人结果,认为与临床观察和考虑不符的情况下,实验室会对临床样品再做一次检测。如果前后两次结果非常相似,临床和病人,包括你自己都认为,检测结果很准确!其实这是重复性好,根本不是准不准!临床实验室对自己报告结果的质量,首先要关注的是精密度!做好每个项目的精密度控制,是第一位的大事!
我认为临床实验室的任何检测必须理解、考虑基质和基质效应,下面我从几个方面进行下基质效应的相关介绍:
1、从临床检验方法学历史演变说起,以肌酐检测为例
大多今天的检验,除了上述的单次检测之外,实验室已经习惯了自动化。但是,至今很多基层实验室,一边在使用自动化的检测系统在进行样品检测,一边还是在按照手工操作时的习惯,在思考问题和做法。例如,试剂可以按照自己的需求去任意选择;校准品还是把它视为原先的“标准液”那样,一个校准品可以用于任何仪器和试剂的组合。这样检验结果就有了!可惜的是,我们很多医学院校的检验系,根本没有理解今天的自动化,对实验室带来的冲击究竟有多深和多严重!所以,各位检验同道,没有从深层次上去认识:今天的自动化,已经使检验的许多观念,完全不同于原先的手工操作的那些老的观念。如果还停留在以往的老认识和做法,我们难以做出有质量的检测结果!不要简单地将自动化,就当做它代替了原先我们的一双手的手工操作!现在的自动化和先进技术,远远超出了替代手工操作的作用!因此,不从根本上去认识医学检验基础问题,还不能将你们的一些简单认识,扭转过来!
认识基质和基质效应,应该是最重要的。我从最老的肌酐的苦味酸检测说起。Jaffe在1886年观察到在碱性条件下肌酐与苦味酸反应形成红色。该反应以他名字命名,已经经历了133年检测的年代。1904年,Folin应用Jaffe反应检测尿液的肌酐。可是,从Folin应用起,至今还没有弄清楚:究竟肌酐与碱性苦味酸是怎样反应的!即:肌酐的Jaffe反应只是一个现象的描述,不是什么反应原理!所以,肌酐的Jaffe反应没有检测原理。其实,从Folin开始,推出的Jaffe肌酐反应,使用了全血标本,经钨酸试剂去除蛋白后,以无蛋白血滤液参与反应的。但是,也因为如此的前处理,无蛋白血滤液去除了血液中的所有蛋白,再进行Jaffe反应时,肌酐受到如今那样的蛋白干扰或基质影响的基质效应大致上是没有的!所以,检测直接使用纯肌酐配置的肌酐标准液为标准,比色检测和计算标本中的肌酐含量。今天的肌酐检测中,遇到的所谓“假性肌酐”的色素问题都是自动化要求肌酐直接检测引入的!
肌酐检测方法从国外引入国内。我1965年开始接触检验的时候,全世界无一不使用无蛋白血滤液进行肌酐、葡萄糖和尿素(氮)的检测。没有任何现在遇到的实验室间检测结果不一致的严重问题。因为,方法学一致。当时检验界知道结果是否对,先看肌酐标准液准不准,然后看你的无蛋白血滤液做的好不好。以两个方法学或两个实验室结果的比较,可以确定有无问题。因此,方法学比较很早被检验界认识和使用。
在上世纪的70年代,受国外自动化的冲击,在国内当时出版的书中,开始接受直接使用血清或血浆,不进行无蛋白血滤液的处理,即可进行碱性苦味酸反应,比色测定的方法。很快,这样的肌酐方法在国内普遍采用。由于没有任何质量控制,也没有考虑与以往的无蛋白血滤液结果是否符合,很快推开了。以后,为了避免这样的肌酐检测方法受很多“假”肌酐的干扰,而提出速率法的检测等。但是这些方法依然没有考虑使用纯肌酐标准是否对检测结果的可靠性影响。这样的检测方法学在上世纪90年代出版的书籍中依然这样写!
2、基质和基质效应——从上世纪80年代我开始意识到“基质效应”起
早于1985年,我在生产控制血清中发现将纯肌酐配制于透析后的人血清(经透析后已不存在肌酐)内,为了解配制的可靠性取样检测,发现检测的肌酐量明显低于计算的预期量。经回收实验证实,认为肌酐方法的回收率“有问题”。在实践中我懂得了:要使血清样品的检测结果准确,应该将标准物质配制于血清中为标准。在检测时,同时检测加过与未加过标准物质的血清。将加过与未加过标准物质的检测信号相减,即为添加的标准物质在血清中的真实检测信号。以该实际反映的响应信号大小去估计样品内的肌酐含量,这样的结果才是可靠的。但是,是检测方法对检测的干扰、还是血清内的什么造成了结果的差异,当时还不知道这就是“基质效应”。上世纪90年代的一次上海中美临床检验国际会议上,认识了Dr. Fred D. Lasky。他的演讲令我大开眼界,第一次知道了matrix词语。(当时他服务于强生公司)
现今检验同道似乎对基质效应并不陌生。可是要真正认识,并用于临床检验实践,还有很大距离。有没有认真思考以下一些问题:
以往传统的临床化学检验,大多使用无蛋白血滤液,这是为什么?为什么今天都要求使用校准品校准,而不推荐使用纯物质配制的标准液?为什么校准品不能像标准液那样可以任意使用?必须在指定的检测系统上,某个校准品才能为该检测系统校准?既然控制品是采用人混合血清制备的,为什么控制品的结果不能说明检测系统的正确,只能说明检测系统的精密度?为什么现有的检测系统,尤其是免疫项目产品,每换一个批号的试剂,检测结果就会有变化?有的厂商要求必须使用新的校准品定值?
基质(matrix):在临床检测的分析环境中,除了分析物以外的所有其他物质和组分称为该分析物的基质。基质效应(matrix effect):检测系统检测标本中的分析物时,处于分析物周围的所有非分析物质(基质)对分析物参与反应的影响,称为基质效应。如何理解?该分析物的基质,应该包括所有涉及检测的“组分”。检测样品没有试剂的参与,没有校准品的校准、没有分析仪的检测,就没有检测结果。广义上,它们都是检测过程中的基质。
我将不同基质效应涉及的基质,分为三个层次:1)检测样品与纯标准液间的基质差异;2)稳定化的病人血清(处理过样品)作为校准品与病人血清间的基质差异;3)不同批号试剂参与反应中的差异所致的基质差异。
3、从第一层次基质效应想到的
历史上,Folin-Wu等开创了临床化学检验的定量技术。无论是葡萄糖或肌酐等的检验,都毫无例外的必须对全血进行无蛋白处理。当时这些前辈并不清楚“基质效应”。但是,为了克服蛋白等样品中的成分对葡萄糖或肌酐检测的影响,实践证明必须使用无蛋白血滤液。其实,这就是在检测中,先去除非分析物的“基质”,才能使检测结果可靠。
今天,虽然碱性苦味酸的方法可以直接检测血清内的肌酐。但是,这些非肌酐基质的(主要是血清蛋白)存在,一定会影响肌酐结果的可靠性。除了肌酐以外,应该清醒认识到任何项目,样品中相对于分析物的非分析物(基质)都会对检测结果有基质效应,只是影响大小而已。
自动化推广应用认识到,今后不应再使用纯物质配制的标准液校准检测系统。因为,纯标准液和病人标本间的基质差异。最好使用混合血清作为“标准”,校准检测系统。以这样的方式可以对大多结果“正常”的标本内非分析物的基质效应予以抵消。但是,危重病人标本的基质状态与“正常”标本的基质状态有着非常显著的差异。因此,相对而言,基质效应无法完全消除。
标准液是采用纯物质配制的,内含分析物浓度是可以计算出来的。采用病人混合血清为“校准品”,其内含的分析物浓度无法配制计算而得。必须依靠检测系统的检测。因此,校准品的定值一定与检测它的检测系统关联。所以,校准品不是标准品,但它对检测系统实施了校准,故被称为“校准品”。新鲜混合血清至今是最佳校准品。可是,无法长期保存。因此在市场上需要有校准品和控制品的制品。但是,校准品和控制品为了迎合实验室需要,都是经过加工处理后的产品。为了达到实验室需要的分析物浓度,外加了“非人来源”的分析物,它们在参与分析反应中的情况与天然病人样品的分析物有差异。因此,又是一个特殊的基质问题。因此,造成病人样品与处理过样品间结果不一致的原因,还涉及“分析物”本身!互换性关心的,除了因处理过样品与病人样品间基质效应外、还有因它们间分析物的差异问题。
4、处理过样品与新鲜病人标本间的基质效应(第二层次基质效应)
采用真实的病人血清作“标准”(校准品),校准检测系统,再由该检测系统去检测病人血清,以此克服标准液和真实血清间的基质效应。但是,该“标准”血清内也含有要检测的分析物,它的浓度为多少?需要采用检测系统先检测。不同的检测系统(方法学、检测程序)对该“标准”血清的检测结果不同。因此,校准品的定值一定与检测它的系统有关。即:校准品的值依赖于检测系统;也一定没有各个检测系统通用的校准品。
“处理过样品”(Processed Sample)的名称是因为:1)新鲜的原血清无法长期保存,必须对它进行防腐处理。或是加入防腐剂、或是冷冻干燥;2)冷冻干燥处理后使血清内部分内含脂蛋白变性,复溶液体变得浑浊;而且这样的浑浊随着冻干血清保存时间的延长越来越严重。对使用带来困难;3)为了尽可能使复溶的冻干品变得清晰,大多厂商在制备中,先行去除α-脂蛋白,又经透析等处理;4)原有混合血清内各个分析物浓度不理想。对于过多的分析物采取透析或沉淀、吸附等处理;对不够的分析物则采用加入各种非人来源的原料,使其达到“理想”的水平。但是,这样处理后的原混合血清就与新鲜血清样品间产生了新的基质差异。
关于校准品、控制品的添加物(示例),有公司提供的信息,以下在校准品和控制品中,前面为分析物名称,后面有下划线的为添加的物质:
酸性磷酸酶 人前列腺(重组)
ALT、AST、LD 猪心,GGT 猪肾
白蛋白、胆固醇 牛血清
ALP 人胎盘(重组),淀粉酶 猪胰
胆碱酯酶 人血清,肌酸激酶 兔肌
GLDH 牛肝,脂肪酶 人胰重组合
转铁蛋白 人Cohn Ⅳ组分
甘油三酯 鸡蛋黄,碳酸氢钠。
因此,各种内部质量控制和室间调查用的控制品(controls),和校准品(calibrator),都经过加工处理,例如:冰冻、冷冻干燥、加稳定剂、添加某些分析物等,都是处理过的样品(processed sample)。它们都不是日常检验的新鲜病人样品。在平时,检测新鲜病人样品时不常见的偏移(bias),在检测处理过样品中却常见,因为在处理过样品中有新鲜样品没有的基质变化。这是新鲜样品与处理过样品间的基质差异产生新的基质效应。
临床检验结果的正确度是检验可靠性的重要方面。为此,政府机构强调实施室间质量评估计划(proficiency testing or external quality assessment),作为评价各实验室正确度的依据。但是,现有数据说明,简单地从室间评估数据说明正确度不一定可行。下发的各种室间调查用的控制品(controls),都经过加工处理。例如,冷冻、冷冻干燥、加稳定剂、添加某些分析物等,都是处理过的样品(processed sample)。这亦包括室内控制用的控制品和校准品(calibrator)。它们都不是日常检验的病人新鲜标本(fresh specimen)。由于这些基质效应,以室间调查来评价检验正确度,若不重视会导致不正确结论,甚至会带来不应有的行政处理。
基质效应涉及各个检验专业项目,表现有所不同。在分析中,仪器设计、试剂组成、方法原理、控制品、校准品、室间调查材料的组成和处理技术是产生基质效应的因素。它们间的互相作用又使基质效应变得更为复杂。对这类基质效应的观察,是了解某检测系统(包括方法学、仪器、试剂、操作程序等)在检测处理过的样品时,和病人新鲜样品结果间具有不同的偏移大小。但是,只用一种检验方法检测处理过的样品和病人样品标本时,无法看出这种偏移。
只有通过方法比较实验,假定某参考方法对病人新鲜样品和处理过的样品均能测出可靠结果,若被评价方法对新鲜病人样品的检测结果和参考方法比较具有的偏移明显小于两方法对处理过样品对比具有的偏移,即可说明该方法在检测处理过样品时具有的基质效应。显然,所有评价基质效应的实验都是相对的。基质效应是对产生误差的解释,还不能阐明效应的真实机制。
EP-14A2文件的实验方法可以使实验室知道:使用的校准品、控制品或室间调查样品等的“处理过样品”,在实际使用中,它们的表现是否与新鲜病人标本“一致”,即是否具有互换性。但是,究竟在实际应用中,我们是怎样做的?这需要弄清楚。大致上,处理过样品的产品可以分为:正确度控制品(物质);校准品;一般控制用的控制品和室间调查品。为了克服纯标准液与新鲜病人样品间的基质效应,使用与新鲜病人血清有明显基质差异的处理过样品,作为某个检测系统的专用校准品。实验室应该完整理解和正确使用“校准品”。
临床重视的是如何确保病人样品检测结果的可靠性。但是,不同试剂、仪器的组合对处理过样品的检测结果都不一样。被用作校准品的处理过样品,实验室还必须使用它去校准检测结果的可靠性。如何为校准品定值成为了一个关键!
5、校准品的定值
为了确保实验室对病人样品检测结果的可靠性,首先有效的做法是:公司必须固定仪器、试剂、与校准品的固定组合!第二,公司必须向国际公认的参考实验室申请,委托他们使用国际公认的参考系统(参考物质与参考方法)为一批新鲜病人样品确定参考值。然后,公司以这些血清的检测参考值结果为准,在自己的仪器、试剂、校准品固定组合的检测系统上,以这些血清作为标准,经过反复检测,不断“调整”公司校准品的值,使该校准品的“调整值”对公司的检测系统校准后,对这批具有参考值样品检测的结果与参考实验室对这些血清给出的参考值一致。此时,该校准品的定值被确定下来。
上述的校准品定值是在方法学比较中,经过反复比对、调整得到的。因此,校准品的定值只能为被“调整”出来校准值的检测系统服务!所以:1)仪器、试剂、校准品和操作程序组合的检测系统,是第一位重要的!不可任意更换!2)校准品的定值专为检测系统服务的!
所有市售的校准品都只能为公司的检测系统服务,专用于该检测系统。只有这样的校准品才是真的。市场上有些公司的试剂盒也有校准品供应。须注意:任何校准品的专用性,如果提供者承诺任何仪器均可以使用的,如果只有一个校准值的,一定是问题。
6、由试剂引入的第三层次基质效应
上述的第一层次基质效应和第二层次基质效应讨论的,均为病人样品内的基质与纯物质的水溶液或与处理过样品间基质差异引起的基质效应问题。没有涉及样品参与反应时,由试剂引入的基质效应。其实,引入基质效应的情况非常复杂。试剂在参与反应时也引入了基质效应。
试剂必须参与反应方能得到检测结果。因此,不同批号引入的试剂,因其内含各个试剂成分的细微差异而造成的分析环境变化,是不同批号试剂检测结果不同的基质效应。
试剂厂商在生产成批试剂时,尽管使用了现有最好的设备。但是,试剂需要控制各个组分的准确含量,并且确保加工处理的各个环节可重复。大规模生产采用的称量可以很精确,但是,要配制成精确量的容量设备缺如。唯一可行的是以称量替代容量。对配制量达到数千升时的称量,在度量容量上使用称量方式引入了很大的误差。这仅是成批试剂配制时引入的一个问题。
其他诸如:各个试剂组分原料批间差异、调节pH的误差、离子强度差异、每批抗原来源和纯化差异、抗体来源和本身的免疫反应亲和力等差异、表面活性剂分子大小等的差异等,均会严重影响每批试剂内含组分的差异。配制中的搅拌速度、分装时间的长短、分装使用设备的清洗和灭菌问题、分装后的充惰性气体完整、冰冻干燥时各瓶试剂在冷冻箱内的位置等,也都会影响试剂质量。因此,试剂厂商提供的试剂批间一定有差异,只是在临床化学等产品上表现不明显。但是,对于免疫试剂,则批间差异表现很突出。
各批试剂与同一个人新鲜样品内的分析物反应时,各批试剂间的反应会有差异,这是样品参与反应的差异,即基质效应。同样,各批试剂对于“校准品”和“控制品”这些处理过的样品的反应更会有差异,它们与新鲜人血清间在参与反应中的差异,更是新鲜人血清与处理过样品间的明显基质效应。
为了确保同一个病人样品使用不同批号试剂得到的结果一致,在确认不同批号试剂的基本分析性能下,惟一有效的方法是以具有参考值的人血清为依据,调整每批校准品对于每批试剂的校准值。然后,再按照溯源性要求,以常规新鲜样品再次进行参考方法与某批号试剂加上为之调整校准值的校准品的检测系统,进行方法学比较,符合要求后方可让该批号试剂上市。这是为了克服客观存在的基质效应,才必须采取的措施-每批校准品对于不同批号的试剂具有不同校准值。
为了确保每批试剂对同一个病人样品的某项目分析物的检测,可得到相同的结果。通过标准化,对每批新试剂必须配合每批试剂专用的校准品的定值(即使是相同批号的校准品,对不同批号的试剂必须具有相应调整的校准值)。由于参与检测的试剂和样品反应中的基质效应,必须对每批试剂配合专用的校准品值,确保每批试剂对相同病人的检测结果得到一致的结果。
因此,相同批号的控制品,使用不同批号(相同厂商产品)的试剂一定会得到不同的检测结果。所以,按照质量控制要求,每换用试剂批号时,必须重新设定控制均值和标准差。
基质效应是当今临床实验室每天面临的现实问题,它越来越被临床实验室重视,应该予以充分理解和重视。一定不要忘记:任何项目(分析物,更正确的是被测量)被要求结果的可靠性,这个结果是新鲜病人标本的检测结果!不是任何控制品或室间调查品的结果。因为它们与新鲜病人样品间的明显基质差异。在可能的情况下,实验室应不使用纯标准液校准检测系统。采用检测系统专用的校准品确保检测质量。没有通用于任何仪器、试剂、操作程序的校准品。重视每天的质量控制,始终将病人结果可靠性放在实验室工作的第一位。
因此,必须使用新鲜病人标本作为了解结果可靠性、一致性的根本。懂得和理解检测系统的概念和重要性。并在日常工作中坚持使用固定的检测系统对病人标本进行检测。必须使用与检测系统配套的校准品。不要忘记校准品是“处理过的样品”。它的校准值只能用在固定的检测系统上!决没有通用的校准品(即一个校准品,只有一个校准值;却可以用于任何组合的仪器、试剂上)。理解不同批号试剂,需要对同一批号的校准品给予不同校准值。因此在换用试剂批号时,必须同时更换校准品或校准值。控制品也是“处理过样品”。常用的控制品与新鲜病人标本间没有互换性。所以,每天的质量控制只是不精密度(即重复性)的控制。没有正确度的控制。换用试剂批号时,也需要注意及时比对,调整控制品的均值。期望始终将临床的需求和病人利益放在我们临床实验室工作的第一位。
《临床实验室》:前面的介绍您一直强调检测系统的校准,您能介绍下什么是临床检验的检测系统?
冯仁丰教授:我们必须重视检测系统,什么是临床检验的检测系统?完成一个项目检验所涉及的仪器、试剂、校准品和操作程序等的组合,为检测系统。若是手工操作,还必须包括具体的操作人员。实验室只有自始至终地坚持不更动每个检测项目使用的检测系统,才能确保实验室每个项目的检测结果具有可比性。
什么是ISO 17511指的测量系统或测量程序?在文件引言中指出:生物样品中量的测量要求参考测量系统,包括:确定生物样品中分析物,以及测量结果的预期临床应用;确定人样品中选定量的参考测量程序;适用于选定量的参考物质,如一级校准品和可以替代的二级具基质校准品。
对样品的检验,必须使用仪器、试剂、校准品、和操作程序组合的检测系统。没有检测系统的固定组合,也就不可能实现样品检验结果的可追溯性。ISO 17511的要求是建立在已经具有良好性能的检测系统上,论述检测系统如何实现对样品检验结果的溯源性。
因此,单纯的试剂盒没有说明指定在什么仪器上、也没有校准品的,无法证实它对病人样品检验结果的溯源性。单一的仪器,没有说明使用什么试剂盒,也没有指定的校准品,也无法证实任何溯源性。
王义夫之所以能够得到世界射击冠军,他使用固定品牌与型号的气手枪;使用与枪配套的品牌和型号的子弹;使用固定的校准程序;经长期练习形成的射击程序。这就是王义夫获得世界冠军的射击系统。可是,目前大多临床检验科的认识是,一枪定天下的关键是枪,所以要一把世界闻名的气手枪;子弹只要能用就可,哪家便宜用哪家;对枪的校准视射击效果而定,凭经验估计;只要凑合能打,关键是人的本领!因此,随意更换使用的试剂和校准品,没有固定的检测系统,是当前大多临床实验室的现实表现。难以确保对病人样品检测结果的可靠性。
《临床实验室》:现在国内临床实验室也越来越重视实验室质量控制,请您能谈谈质量控制及其重要性?实验室应该如何开展质控?
冯仁丰教授:实验室开展的质量控制实际上是控制了检测系统的检测质量,上述示例清楚地说明了,要得到可靠的、具有溯源性的结果,必须固定实验室使用的检测系统的组成!千万不可任意更换!没有检测系统的概念,今天在做的检验无法说明采用检验使用的系统的质量,何来检测结果的质量!实验室主任必须对实验室使用的所有检测系统质量负有不可推卸的责任!下面我从三个部分介绍下如何进行质量控制:
1、什么是质量?
质量管理应理解为管理质量;质量评估应是评估质量;质量保证应是保证质量;质量控制应是控制质量。上述的每个词语都涉及质量。实验室必须说明:什么是你实验室的质量?这个质量涉及两方面:一是实验室确定的质量目标;二是实验室目前现有的质量水平。什么是临床实验室的质量目标?大多实验室中很少理解。没有质量目标,那么质量控制在控制什么质量?我经常在解释质量控制时,说得很通俗,天天、月月、年年一样,就是在控!其实,这是对目前国内大多实验室没有确定质量目标下,仅仅以现有的操作质量水平为准下,只要每天都“差不多”就算在控了。这是实验室认为,目前这个分析物的检测质量水平是可以的。期望保持并不要出现比这样的质量更差的水平。其实这就是实验室具有的操作水平(State of the Art)。具体表现为误差水平。问题是,临床实验室是否对这个操作水平的现有误差水平,具有文件记录?有无具体的误差大小的内容?没有!
涉及检测质量的几个大类
分析前的规范:收集病人样品。包括病人准备、标本管患者信息完整无差错、采集标本时病人的姿势、标本运送和储存要求、分离血清血浆的及时和到位、样品从离体到检测时间的限制等,是否都有规程?
第二是检测系统的选择、分析性能的评价或验证;仪器的定时保养;仪器重大保养后、试剂批号更新后的系统再次性能验证。这些是否都建立和实施了规程?开展QC问题:有无控制品的复溶、系列处理的操作规程?包括:复溶规程、分装规程、冻融规程、建立均值和标准差规程、有无试剂批号更换时重新确认均值和标准差的规程、进行质量控制要求记录内容的规程、失控处理规程等。千万不要将开展质量控制视为特殊内容,将其特别对待!越是以平常心态去处理,越反映实验室的实际状态下的质量现状。
2、开展每天质量控制的前提
实验室是否具有了检测系统的牢固概念?是否对检测系统的分析性能进行了确认或验证?是否实验室完全按照自己编写的操作规程,如实进行病人样品的检测?有无进行质量控制的操作规范?实验室的所有人员都经过了QC的培训?
ISO 15189 2012中第5.5.1.1节总则中:实验室应选择与其用途经过确认的检验程序,应记录检验过程中从事操作活动的人员。每一个检验程序的规定要求(性能特性)应与该检验的预期用途有关。注:首选程序可以是体外诊断医疗器械使用说明中规定的程序……第5.5.1.3 检验程序的确认:实验室应对以下来源的检验程序进行确认:a)非标方法;b)实验室设计或制定的方法;c)超出预期范围使用的标准方法;d)修改过的确认方法。
方法确认应尽量全面,并通过客观的证据(以性能特征形式)证实满足检验预期用途的特定要求。注:检验程序的性能特征宜包括:测量正确度、测量准确度、测量精密度、分析特异性、分析灵敏度、检出限和定量限、测量区间等。在美国的CLIA’88法规中,规定定量检验的分析性能为:精密度、正确(准确)度、检测范围、分析灵敏度、分析特异性和参考范围。
这些也是定量检验的质量水平的体现。检验总有误差。所谓质量就是这些分析性能表示的误差大小。公司产品说明书中各个性能指标就是公司产品质量水平的体现。保持和改进这些性能水平是质量管理的重要内容。
3、分析性能的确认
临床实验室使用的检测系统,目前绝大多数均为商品,来自制备厂商。厂商为了让实验室相信,它们的产品可以做出令临床满意的检测结果。因此,对实验室需要的六个分析性能(精密度、正[准]确度、分析范围、分析特异性、分析灵敏度、和参考区间),采用国家或国际的实验文件(如美国的CLSI)进行实验,逐一建立各个分析性能。这样的过程是分析性能的确认(Establishment或Validation)。当实验室采购了某个厂商的固定检测系统后,在进行检测患者样品发出报告前,实验室一定要验证:厂商提供的分析性能是否真实。所以,实验室必须亲自动手进行必要的实验来验证这些分析性能。验证性能的目的是双向的:1、厂商产品的真实可靠;2、实验室是否能做出符合产品分析性能的检测结果,说明实验室掌握了该检测系统。
目前,实验室懂得和知道对检测系统性能的验证。但是,最大的问题是:实验室在新检测系统引入实验室后,厂商负责安装和调试外;也包括了对检测系统性能的验证实验。实验室只是在验证实验报告上签字完成了这个验证!这是厂商安装了仪器后规范行为!不是实验室自己的验证过程!可是一旦使用中认为有问题了,即刻通知厂商解决问题!所有一切全部由厂商承担!
因此今天的实验室变成:实验室做检验、收费进医院和实验室;有问题厂商负责!实验室几乎对检测质量不负任何责任!实验室的责任何在?这样的扭曲状态遍布全国! 在实验室内,实验室人员只是上机操作员,较全面了解每个检测项目的很少;一问三不知!完全丧失了管理中要求实验室验证性能的内涵!尤其是,实验室为了节省成本,在购买检测系统时,往往单独买一个仪器;然后在众多的试剂盒市场中去挑选最便宜的、关系最好的厂商,自行搭配组合成“自建”的检测系统。而且还经常在换试剂来源!因此,这样的实验室在进行患者样品检测前,没有资格进行所谓分析性能的验证,而是必须像检测系统厂商那样,去建立检测系统,即确认新组合检测系统的分析性能是否符合临床需求。
国内有那么多的试剂厂商,由于国内很多的扭曲做法,加上国家药品监督机构的错误行为,认为使用了“具有溯源性”的校准品后,我们所有的结果都具有了溯源性!却不懂得:校准品的校准值只是检测系统固有的!决没有所有检测系统共有的校准品!今天的国内检验界采用的所有试剂盒,全部使用了罗氏或Randox的校准品!完全丧失了检测系统的可靠性!太悲哀了!!
《临床实验室》:国内临床实验室在质控上仍处在起步阶段,还要多多借鉴国外实验室在质控上的经验,您能简单介绍下发达国家的临床实验室在QC上做出的努力么?
冯仁丰教授:下面跟大家一起回顾下世界临床实验室QC之路:
1、世界临床实验室QC的进程,从单纯无序的QC进入了正规全球接受的Westgard多规则QC;不断更新的Westgard多规则QC;与分析性能Sigma水平结合、以临床需求为目标的Westgard Sigma规则的QC;考虑QC检测风险的连续检测 “病人标本数限定区间”QC安排方案。
2、上世纪70年代Westgard的认识和行为
上世纪70年代Westgard强调了分析性能的重要性。1981年,Westgard提出的多规则,应该是以控制在 (2Σ)水平为基础建立的。以12S为警告规则也就很正常了。1982年,Westgard发表了什么是质量控制的质量,开始强调了,临床实验室的质量应以满足临床对病人的诊断和疗效的观察为目标。否则,质量控制没有意义。
3、Westgard传统和现代的多规则,是上世纪80年代起至今的重要控制方法。
为全球临床实验室开展的每天QC,从理论到实践奠定了扎实基础。可是,只是实现了以实验室现有的操作水平为目标的QC。在Westgard之前,尽管也有不少论述临床实验室开展质量控制的专著和文献。但是究竟每批检测需要做几个控制品、应该如何选择合适的控制规则,怎样才算是在控和失控?失控后该怎么处理?在开展质量控制前的基础要哪些?等等都说不清。如何从控制理论上转化为实际可操作的控制方法。对这些做出最大贡献的,就是Westgard。
因此,毫不夸张地说,Westgard是当代临床实验室质量控制的开拓者和奠基者。时间过得真快,Westgard发表的多规则控制程序的文章距今已经38年了。“Westgard多规则”闻名全球。Westagrd当初就是想解决临床实验室在每天质量控制中,如何使每个检验人员可以在判断失控上有一致的认识。由于该控制程序概念清楚,很快就被仪器厂商和临床实验室人员广泛接受。国内也几乎在1981年后开始宣传推广,该程序已在全国各个临床实验室普遍采用。
Westgard对QC的贡献:1)质量控制控制什么?控制误差。但从理论上,提出误差分为检测系统稳定状态(固有)误差及除此之外的不稳定状态(外加)误差,质量控制只能控制外加误差;2)Westgard以概率理论发展了各种控制规则的误差检出特性曲线。由曲线反映规则对外加误差检出的灵敏度;以及把固有误差误作假性报警的可能性,即误差检出的特异性;3)发展了多规则程序,由计算机自动检索,大大提高了质量控制效率。使失控误差检出率大大提高,又极大地减少了假性报警的概率;4)要使检验结果真正符合临床要求,必须对检验方法作严格的评价。Westgard从理论和实践上提出了完整的方法学评价实验及总误差概念。
4、Westgard多规则的遗憾
Westgard多规则确实推动了全世界临床实验室的QC。但是,Westgard多规则并没有解决以质量目标作为质量控制的手段。也即,还是以实验室具有的现有操作误差水平(State of the Art)为控制目标。它满足了实验室认为的质量,即目前分析物的检测质量水平是可以的。期望保持并不要出现比这样的质量更差的水平。还有,长期以来,Westgard一直没有关注:究竟每批病人样品检测数为多少,可以确保检测质量。也即,进行QC检测可确保真正在控的病人标本数为多少?近几年来,Westgard推出的以临床需求的质量为QC的目标,开展了6Σ控制方法。但还是回避了每批检测病人标本数是否需要控制的大问题。
5、Dr Parvin关注实验室的质量控制:应该将QC做法的设计确保病人检测结果的可靠性,不是仪器的运行是否正常。
1)他强调了今天自动化分析仪上开展的质量控制,只是“控制”了仪器是否正常,不是关注在仪器上被检测的病人标本的检测结果的质量。
我的学习体会:上世纪50年代临床实验室是手工操作年代。当时被检测病人标本、标准液、空白液和控制样品都在一个试管架上。完全依靠操作人员的手工操作完成检测。在这样的情况下,由于手工操作的做法(例如,分别取样后,需要加入各个试剂时,是对所有样品一起顺序假同一个试剂。再加第二个试剂等),所有被检测的病人结果和控制结果互相关联。因此,控制结果是否在控可以说明这试管架病人标本的检测结果是否可接受。
可是,在自动分析仪上对样品的检测,因仪器的设计为分列式,所有每个被检测的样品都是被仪器独立地检测完成的。因此,控制结果在控,说明该控制品仅在被检测的时间点是符合要求的;但是它无法证实,以后紧接着的病人标本是否如控制品那样被完整地检测。也许就在该控制品检测后,出现了问题造成检测误差或仪器的故障,使以后的病人标本检测结果出现问题。要看这个问题所致的误差大小,是否大至下一个控制品检测被发现,出现失控表现,方使实验室知道出现失控了。
但是究竟这个问题出现在什么时候、究竟问题有多大?实验室究竟要对多少病人样品进行重新检测?这样的问题一直是现今各个实验室在质量控制中的困惑。因此,Dr Parvin认为,必须要将质量控制关注的重点放在检测的病人标本结果的质量上。质量控制策略的设计要关注如何确保报告的病人检测结果质量。国内能够做QC已经不错了,至于失控下几乎没有对标本重新检测,问题更为严重!
2)从统计学上,认为QC在控表现使报告的病人检测结果可靠的可能性很大。平时一直以均值加减2SD作为是否有问题的判断限。只要控制值在加减2SD之内,实验室即刻判断该批检测结果在控,没有问题。可是从统计上,这只是说明有95%的可能性,所有的检测结果在控。但是,还有5%的检测结果会超出加减2SD!这意味着,每100个病人检测结果中有5个检测结果不正常!这个比率不小!今天如果允许出问题的可能性需要保持在1%以下,那么这样的做法就是今天传统的质量控制没有解决的问题!因此,Dr Parvin坚持要将质量控制关心的重点,从关注仪器是否在控,转变为关心每个检测病人结果是否在控。我个人认为这是质量控制认识和做法上的重大转变!要关心病人结果是否“可靠”,而不是仪器是否运行“正常”!
Dr Parvin的观点虽然非常有道理,可是如何具体设计和操作,没有一般实验室可以看到的资料,除非去购买Bio-Rad的专用软件(Mission Control),这为实验室的实际应用有巨大的困难!Dr Parvin的认识,被Dr Westgard接受,改变了Westgard一直未能重视分析批量的观点,完全按照Dr Parvin“限定病人标本数的QC策略”,加上Westgard采用Sigma度量选择质量控制方法,写出了Westgard最新的QC策略。
6、美国临床和实验室标准委员会(CLSI)的C24-Ed4标准文件“定量检测程序的统计质量控制:原则和定义”,是Dr Parvin为主席编写的。为消除患者风险,在新的CLSI为SQC导则(C24-Ed4)上,推荐了“限定(病人标本数) [bracketed]”的统计质量控制(SQC)。限定(病人标本数)的SQC,要求在检测限定的一组病人样品前和后,均要进行QC检测。还要为检测中出现影响检测质量的关键点,必须进行QC检测,确认没有问题(关键点QC)。既要保持质量,还要有助于高产出分析系统的连续操作结果进行相应报告。
7、限定区间QC的意义:每天质量控制必须在检测的开始起就有QC,然后按照要求,在一定病人标本数后再进行QC检测。前后QC间限制了可检测的病人标本数。称为“限定区间QC的安排”即“限定(病人标本数)区间[bracketed] QC”,因为一个“限定区间[bracketed]”的开始和最后QC的结果,用于确认了,在“限定区间”内检测的病人结果是可接受的。实验室应随同限定区间内SQC事件,发送和报告病人检测结果。
Westgard建议的多步骤SQC:在更多地考虑费用有效性下,可考虑一个多步骤的SQC设计,即“一个控制程序涉及两个或更多不同的设计,在合适时从一个方式转换为另一个方式”。例如,一个多步骤控制程序可具有一个“启动”的设计,用于初始的检测;一个“监视”设计,用于在开始后的常规运行;而一个“回顾性”的设计可用于评审在一个较长的周期内;不是一个单批检测的控制数据。
《临床实验室》:能请您简单分析下当前国内临床实验室的质控现状么?
冯仁丰教授:在过去的近40年里,临床实验室的检测手段发生了巨大的变化。随着自动化的不断发展,其中有仪器的自动化进步和智能化;以及检测方法学的发展,与自动化配合,分析性能得到了极大的提升。因此,强烈地意识到,使用分析性能优良的检测方法,开展QC也变得越来越好!中国也一样发生了天翻地覆的变化!上世纪的1983年,在全国检验学会第二次年会上,厂商展出了几台自动分析仪,引起了与会同道的极大兴趣。接着,多家公司开始在国内推广销售它们的自动分析仪。日立是在国内第一个推出它们的分析仪的。它不准罗氏前身(Boehringer)在中国推出检测系统。很快,国内多个实验室有了分析仪。迫切需要试剂配合,推动了国内自行开发或引进试剂。阴差阳错地,我国临床实验室开始了自行组合仪器和试剂,用于检测病人样品。
至今我国难以计数究竟有多少不同仪器和试剂的组合!第一个引入校准品的是德国Diasys。尽管以后大型诊断产品公司推出了完整的检测系统,可是自行组合的做法一直在持续。而且,从国家批准检验收费的好处中,拼命节省试剂成本,严重损害了病人利益。因此,国内先天不足的自动化发展,加上国内非常讲究检测付出的成本!再好的仪器,总是在全国各地有着无限的国产试剂仪器运行!如此杂交品种繁多“检测系统”,在国内为我们老百姓进行真实样品的检测!检测质量是一个最最重要的大问题!对仪器可靠性的崇拜远远高于对试剂的信任!只要仪器好,一般般试剂都可以应付!究竟自行组合的检测系统的分析性能是否符合临床要求?尽管不断地宣传,但是,被基层实验室认可重视的非常非常可怜!
买仪器就像买一辆汽车,试剂就像开汽车需要的汽油!只要能用,检测结果出来,什么试剂都可以用!基层院长都已经看到了自动化仪器对病人标本处理的能力!因此,为了让医院的收益更好,亲自选择自动化仪器、并要求实验室在几天内马上出报告的例子,举不胜举! 但是,在选择试剂上的招标上,许多都是院长亲自“钦点”同意的!原则就是越便宜越好!
在这样的情况下,检测质量低下是必然的!至今,国内还有许多实验室根本没有质量控制,照样发出病人检测报告!有的买一点控制品,在实验室自己也犹豫自己的检测结果时,拿控制品当做宝贝,检测一下,差不多的就可以了!但是,中国在质量控制上最严重的问题远远不止这些!可以肯定地说,因为部分实验室在争取通过ISO 15189的实验室认可,所以按照要求,重视了检测系统分析性能的验证!也知道要做好所有记录!可是,就是没有任何关于疑似被失控影响的病人标本,必须重新检测的明确规定!
前面介绍Westgard控制方法在逐渐深入,这是期望将质量控制越做越好!不知道是国外与国内认识上的差距,或者是我们对老百姓需要准确可靠检测结果的尊重上看法不同,已经被怀疑质量有问题的病人标本为什么就不被大家重视去重做?我们不是政府官员,我们与病人一样都是一般般老百姓!为什么我们在出现失控问题后,会对标本重做如此淡漠?Parvin指出了在全自动分析仪上,进行的质量控制,实际上不是对病人标本的控制,是对仪器运行是否正常的反映!因此,他专门研究了即使在控下,依然还有病人检测结果可能处于的风险!强烈呼吁要缩短两次控制间限定标本检测个数!因为,这样一旦出现失控,可以重做检测的病人标本数不会太多!Westgard接受了Parvin的风险观点,遵循C24-A4的精神,形成了上述的最新做法!这样的做法,在国内面临最大的阻力,就是:难道我们一定要对“失控”的标本去重做?如果我们不再重视这个问题,所有的介绍和推动都是空话!
《临床实验室》:听了您的介绍我们越发认识到实验室质控的重要性,对于中国临床实验室质控未来之路,您有何建议和期待?
冯仁丰教授:我们该做什么?对Parvin的认识和Westgard的推动,我们需要去努力追赶。可是当务之急是,要推动临床实验室的人员要有良心!要认真处理已经被认识可能有问题的病人标本的重做!没有良心,昧着良心,避而不见是一个处理方式。那么,我们可以偃旗息鼓了。还要做什么质量控制?因为真的是做QC等于没有QC的作用! 我们要从头做起!要反复宣传完成检测的检测系统概念!鼓励实验室一定要使用分析性能良好的完整检测系统!这是实现检测质量的头等大事!必须亲自动手进行分析性能的验证!
Westgard近期在他的文章中,采纳了西班牙临床化学工作人员Yago和Alcover的文章,提供了极其有启发性的计算图表,可以选择简单的质量控制规则,可获得每100个样品分析批中相应很低的有缺陷结果的频率。作者建议,不要使质量控制过于复杂,尽可能采用简单的、甚至是很老的计算图表,能够发挥作用就好!而且他还依据Dr. Greg Miller思路,实验室首先要做好检测系统的选择中,在大型实验室应该在各个实验室内尽力使用相同的检测系统。重点就是控制精密度。在此情况下,可以忽略偏移在计算Sigma中作用,可以提高Sigma值!但是,所有一切都是建立在失控一定重做之上的!
在国内目前的情况下,立即推广Westgard的限定病人标本数的质量控制做法,过于先进了。 完全可以从经典的Westgard多规则起,真正地在临床实验室做起来!不在乎知道这些控制规则,对误差检出能力不够的可能性!现在的问题是,即使这样的控制出现失控,我们实验室没有任何措施去支持病人得到可靠结果呀!何况,最新的Westgard第5版上依然还在介绍他的多规则!
考虑到让实验室在出现失控后,除了寻找原因纠正问题外,还应该对出现失控起到前一次在控的期间内,病人标本给予重现检测,以期得到可靠结果。因此,建议每200个标本为一个限定数(可以讨论)。再多一些重做时病人标本数太多;过少的,则实验室感觉控制检测太多。一定坚持每天一开始,必须先进行QC检测!确保没有问题!依然绘制控制图,了解目前控制现状,以及以往的控制情况。
努力寻找真的对病人满怀感情,对失控标本重做的临床实验室,把他们的先进事迹进行重点宣传,鼓励大家向他们学习!突出宣传临床实验室必须爱我们的老百姓!不扭转失控标本不处理的的坏事,中国的临床实验室没有希望了!我们还有什么面目向全世界做出交代!我是在冥思苦想中,对我们临床实验室目前对不起老百姓的表现,提出了挑战!事情总有开始!必须百折不挠!期望实验室同道去努力推动临床实验室真正关爱老百姓的具体作为!供参考!无论如何,国外的实验室每天的检测还是一定有QC!而我们至今还有那么多的实验室没有QC,照样出报告!还是要有良心!要对得起老百姓!将每个前往我们实验室进行检验的每个病人,视为我们的亲人!
冯仁丰教授:我认为怎样做检验的第一个要求是做一个好人,你我大家都是做检验的同行,做了那么多年的检验,怎么还要讲“怎样做检验”?理由很简单,做检验,首先要做一个好人!做一个有良心的人!做一个有事业心的人!做一个对得起老百姓的人!才能做出有质量的结果!没有这样的前提,检验做得再多,你只是糊涂过日子!乱出报告,不但病人的钱白花!甚至会危害病人的及时诊断和治疗!
平时,我们的实验室人员说,我们有QC!就是有QC,还有许多问题!你能做QC,说明实验室有了质量概念!但是,你真的理解了质量了吗?每天的QC在控,实验室都认为我们的质量很好!真的是这样吗?我估计有很多问题!按照正态分布的规律,一个QC检测结果被认为在控,是说:它的结果有95%的可能性在 之内。走遍世界,任何临床实验室都知道!可是,再认真想一想,如果每天发出100个相同检测项目的检测结果中,会有5个结果也许已经出了问题!它不在所谓的 范围之内!属于有质量问题的结果被发给了病人和临床!可是临床医生会依据这样的检测结果,对病人做出了诊断和非常不当的治疗!后果是,这样的病人也许就死在ICU病房!或者在家里!就是没有死在实验室门前!可是实验室出具这个结果的人员,丝毫没有感觉;因为我们的结果是在控的!如果这样的病人是你的亲人,你也许会对检测结果有疑问,转而再采样、再检验!做一次不行,要多做几次!还必须与主管医师反复联系!直至做出正确诊断和治疗。你的家属得救了!你感到自己对得起亲人来了!
冯仁丰教授:我一直难以忘怀Dr Westgard第一次来我国介绍Westgard多规则时,我为他做翻译。当时,他使用了家庭的照片,他指着照片说,他有一个非常可爱的孙女。这次,她也跟着他来到中国,不巧她生病了,儿科医师为她检查后,要求为她进行血液常规检验。
他说:“这是我的孙女! 任何人要对她进行检测,你必须得做准确!”他知道,那个医院的检验科,因为是他的孙女,非常认真地进行了检验。包括分析前的采集样品和检测中的质量控制。在发出报告前,还即刻与儿科医师联系,询问病人。知道临床观察和检测结果基本一致下,发出了检测报告,Dr Westgard非常满意。这时候Dr Westgard说,检验科人员对自己家庭成员的检测也应该准确! 因为这是你的亲人!然后,他又说,你们是否面对在科室外等候检测报告的所有病人,也像对待我的孙女那样,认真负责地做好每个检验?我们只有对每个检验都正确地操作,才能实现质量要求!
Dr Westgard与她孙女的合影,充分展现了他对孙女的爱,而孙女坐在他身上,满脸笑容。这是一张充满爱的照片。可是,Dr Westgard指着照片上的他说,假如这不是我,是你,是一个检验人员;我的孙女是接受你检验的病人。你是否也像我爱孙女那样地对待每个接受检验的病人?他说得太好了!我们的实验室人员,一定要像Dr Westgard说的那样,要深深地爱着每个接受我们检验的所有病人!只有对他们充满了爱,我们的检验才会做得好!
因此,怎样做检验的第一个事,我在到处呼吁:“我们临床实验室的每位工作人员,必须要对所有前来被要求做检验的病人,将他们视为自己的亲人!去认真做好每一个检验结果!” 没有这个前提,检验等于白做!甚至在害人! 这就是做人的道德!做人的基本要求!这是怎样做检验的的第一个要求!习近平主席的“平语近人”要好好学习,认真思索。“三严三实”是我们天天要面对的要求,大家要时时铭记、事事坚持、处处上心,随时准备坚持真理、随时准备修正错误,凡是有利于党和人民事业的,就坚决干、加油干、一刻不停歇地干;凡是不利于党和人民事业的,就坚决改、彻底改、一刻不耽误地改。“既严以修身、严以用权、严以律己,又谋事要实、创业要实、做人要实”的要求。让我们一起去认真考虑,我们应该怎样去面对自己的服务对象——病人!
冯仁丰教授:我前面说过怎样做检验的第一个要求是做一个好人,第二个需要认真考虑的是:我们是懂了怎么做检验了吗?在临床实验室第一线工作的同道在学校里学的就是临床检验,怎么会不懂?如果,你只知道一个检验项目在什么仪器上检验,只要样品上仪器,检验就会自动进行。至于每个项目的检测原理、它的分析性能、如何进行校准、有什么容易出现的问题?出现问题应该如何去寻找和排除?都认为与我们没有关系,有问题找试剂或仪器厂商,让他们来解决!解决不了换一家!你多精明呀!!!检验报告是你出的!可惜你连检验是怎么做出来的基本要求都不懂,有问题找厂商!那么,主任为什么还要你在这个岗位上?只要找一个听话、不乱来的人,随便哪个人都可以操作的话,你将没有饭吃了!检验难道就这样不值钱?说明,今天的实验室人员已经“堕落”到如此地步!扪心自问:你是这样的人吗?
今天的实验室,除了临床检验还有些需要手工操作(还有微生物)外,几乎都是自动化了。 但是,千万不要忘记,自动化的检验能够出符合临床要求的结果吗?需要理解和精通很多内容,要做好检验的必备业务要求,还有许多问题需要你回答的。例如,什么是每个检测项目的分析性能?为什么永远要将检测的精密度放在检验结果的第一位?什么是检测系统?如何确保检测系统的完整?每个定量分析性能的含义是什么?如何确认和验证?换用不同批号试剂时,我们应该做什么?不同实验室间相同项目的检测结果的比对,应该怎样做?相关和回归统计说明了什么?开展质量控制的要求?如何看控制结果?如何判断结果是否在控?失控应该怎么做?每个控制规则的含义和理解?发现地区内实验室室间比对差距很大,如何去纠正问题?是否精通每个检验项目的反应原理和操作程序?实验室是否具有真正的操作规范?是自己按照实际操作写的?还是照抄产品说明书?换用不同厂商产品后,应该做什么?你做了吗?自己或家里亲人生病后,迫切需要某些检验项目确诊下,你是否考虑到其他医院去做化验?或者请别人给你再做几个,了解差距?
以上说到的,是全国的通病!越往下走,看到的问题越多!非常害人!因此,凡事要从自己做起!我再三呼吁,每一位检验同道一定要做一个对得起老百姓的人!不仅从良心上是这样,而且在具体检验中,有扎实的技术基础,而且有过硬的操作能力,还有不断学习和提高业务的努力,你才是一个符合要求的检验人员!
冯仁丰教授:临床实验室检验的最突出“特色”是临床实验室对每个病人样品需要检验的每个分析物项目,均只做一次就发出报告。这只是一个统计上的一个抽样!连均值都不如!因此,临床实验室在质量上首先要实现精密度,也即控制不精密度是第一位的大事!临床对实验室出示的病人结果,认为与临床观察和考虑不符的情况下,实验室会对临床样品再做一次检测。如果前后两次结果非常相似,临床和病人,包括你自己都认为,检测结果很准确!其实这是重复性好,根本不是准不准!临床实验室对自己报告结果的质量,首先要关注的是精密度!做好每个项目的精密度控制,是第一位的大事!
我认为临床实验室的任何检测必须理解、考虑基质和基质效应,下面我从几个方面进行下基质效应的相关介绍:
1、从临床检验方法学历史演变说起,以肌酐检测为例
大多今天的检验,除了上述的单次检测之外,实验室已经习惯了自动化。但是,至今很多基层实验室,一边在使用自动化的检测系统在进行样品检测,一边还是在按照手工操作时的习惯,在思考问题和做法。例如,试剂可以按照自己的需求去任意选择;校准品还是把它视为原先的“标准液”那样,一个校准品可以用于任何仪器和试剂的组合。这样检验结果就有了!可惜的是,我们很多医学院校的检验系,根本没有理解今天的自动化,对实验室带来的冲击究竟有多深和多严重!所以,各位检验同道,没有从深层次上去认识:今天的自动化,已经使检验的许多观念,完全不同于原先的手工操作的那些老的观念。如果还停留在以往的老认识和做法,我们难以做出有质量的检测结果!不要简单地将自动化,就当做它代替了原先我们的一双手的手工操作!现在的自动化和先进技术,远远超出了替代手工操作的作用!因此,不从根本上去认识医学检验基础问题,还不能将你们的一些简单认识,扭转过来!
认识基质和基质效应,应该是最重要的。我从最老的肌酐的苦味酸检测说起。Jaffe在1886年观察到在碱性条件下肌酐与苦味酸反应形成红色。该反应以他名字命名,已经经历了133年检测的年代。1904年,Folin应用Jaffe反应检测尿液的肌酐。可是,从Folin应用起,至今还没有弄清楚:究竟肌酐与碱性苦味酸是怎样反应的!即:肌酐的Jaffe反应只是一个现象的描述,不是什么反应原理!所以,肌酐的Jaffe反应没有检测原理。其实,从Folin开始,推出的Jaffe肌酐反应,使用了全血标本,经钨酸试剂去除蛋白后,以无蛋白血滤液参与反应的。但是,也因为如此的前处理,无蛋白血滤液去除了血液中的所有蛋白,再进行Jaffe反应时,肌酐受到如今那样的蛋白干扰或基质影响的基质效应大致上是没有的!所以,检测直接使用纯肌酐配置的肌酐标准液为标准,比色检测和计算标本中的肌酐含量。今天的肌酐检测中,遇到的所谓“假性肌酐”的色素问题都是自动化要求肌酐直接检测引入的!
肌酐检测方法从国外引入国内。我1965年开始接触检验的时候,全世界无一不使用无蛋白血滤液进行肌酐、葡萄糖和尿素(氮)的检测。没有任何现在遇到的实验室间检测结果不一致的严重问题。因为,方法学一致。当时检验界知道结果是否对,先看肌酐标准液准不准,然后看你的无蛋白血滤液做的好不好。以两个方法学或两个实验室结果的比较,可以确定有无问题。因此,方法学比较很早被检验界认识和使用。
在上世纪的70年代,受国外自动化的冲击,在国内当时出版的书中,开始接受直接使用血清或血浆,不进行无蛋白血滤液的处理,即可进行碱性苦味酸反应,比色测定的方法。很快,这样的肌酐方法在国内普遍采用。由于没有任何质量控制,也没有考虑与以往的无蛋白血滤液结果是否符合,很快推开了。以后,为了避免这样的肌酐检测方法受很多“假”肌酐的干扰,而提出速率法的检测等。但是这些方法依然没有考虑使用纯肌酐标准是否对检测结果的可靠性影响。这样的检测方法学在上世纪90年代出版的书籍中依然这样写!
2、基质和基质效应——从上世纪80年代我开始意识到“基质效应”起
早于1985年,我在生产控制血清中发现将纯肌酐配制于透析后的人血清(经透析后已不存在肌酐)内,为了解配制的可靠性取样检测,发现检测的肌酐量明显低于计算的预期量。经回收实验证实,认为肌酐方法的回收率“有问题”。在实践中我懂得了:要使血清样品的检测结果准确,应该将标准物质配制于血清中为标准。在检测时,同时检测加过与未加过标准物质的血清。将加过与未加过标准物质的检测信号相减,即为添加的标准物质在血清中的真实检测信号。以该实际反映的响应信号大小去估计样品内的肌酐含量,这样的结果才是可靠的。但是,是检测方法对检测的干扰、还是血清内的什么造成了结果的差异,当时还不知道这就是“基质效应”。上世纪90年代的一次上海中美临床检验国际会议上,认识了Dr. Fred D. Lasky。他的演讲令我大开眼界,第一次知道了matrix词语。(当时他服务于强生公司)
现今检验同道似乎对基质效应并不陌生。可是要真正认识,并用于临床检验实践,还有很大距离。有没有认真思考以下一些问题:
以往传统的临床化学检验,大多使用无蛋白血滤液,这是为什么?为什么今天都要求使用校准品校准,而不推荐使用纯物质配制的标准液?为什么校准品不能像标准液那样可以任意使用?必须在指定的检测系统上,某个校准品才能为该检测系统校准?既然控制品是采用人混合血清制备的,为什么控制品的结果不能说明检测系统的正确,只能说明检测系统的精密度?为什么现有的检测系统,尤其是免疫项目产品,每换一个批号的试剂,检测结果就会有变化?有的厂商要求必须使用新的校准品定值?
基质(matrix):在临床检测的分析环境中,除了分析物以外的所有其他物质和组分称为该分析物的基质。基质效应(matrix effect):检测系统检测标本中的分析物时,处于分析物周围的所有非分析物质(基质)对分析物参与反应的影响,称为基质效应。如何理解?该分析物的基质,应该包括所有涉及检测的“组分”。检测样品没有试剂的参与,没有校准品的校准、没有分析仪的检测,就没有检测结果。广义上,它们都是检测过程中的基质。
我将不同基质效应涉及的基质,分为三个层次:1)检测样品与纯标准液间的基质差异;2)稳定化的病人血清(处理过样品)作为校准品与病人血清间的基质差异;3)不同批号试剂参与反应中的差异所致的基质差异。
3、从第一层次基质效应想到的
历史上,Folin-Wu等开创了临床化学检验的定量技术。无论是葡萄糖或肌酐等的检验,都毫无例外的必须对全血进行无蛋白处理。当时这些前辈并不清楚“基质效应”。但是,为了克服蛋白等样品中的成分对葡萄糖或肌酐检测的影响,实践证明必须使用无蛋白血滤液。其实,这就是在检测中,先去除非分析物的“基质”,才能使检测结果可靠。
今天,虽然碱性苦味酸的方法可以直接检测血清内的肌酐。但是,这些非肌酐基质的(主要是血清蛋白)存在,一定会影响肌酐结果的可靠性。除了肌酐以外,应该清醒认识到任何项目,样品中相对于分析物的非分析物(基质)都会对检测结果有基质效应,只是影响大小而已。
自动化推广应用认识到,今后不应再使用纯物质配制的标准液校准检测系统。因为,纯标准液和病人标本间的基质差异。最好使用混合血清作为“标准”,校准检测系统。以这样的方式可以对大多结果“正常”的标本内非分析物的基质效应予以抵消。但是,危重病人标本的基质状态与“正常”标本的基质状态有着非常显著的差异。因此,相对而言,基质效应无法完全消除。
标准液是采用纯物质配制的,内含分析物浓度是可以计算出来的。采用病人混合血清为“校准品”,其内含的分析物浓度无法配制计算而得。必须依靠检测系统的检测。因此,校准品的定值一定与检测它的检测系统关联。所以,校准品不是标准品,但它对检测系统实施了校准,故被称为“校准品”。新鲜混合血清至今是最佳校准品。可是,无法长期保存。因此在市场上需要有校准品和控制品的制品。但是,校准品和控制品为了迎合实验室需要,都是经过加工处理后的产品。为了达到实验室需要的分析物浓度,外加了“非人来源”的分析物,它们在参与分析反应中的情况与天然病人样品的分析物有差异。因此,又是一个特殊的基质问题。因此,造成病人样品与处理过样品间结果不一致的原因,还涉及“分析物”本身!互换性关心的,除了因处理过样品与病人样品间基质效应外、还有因它们间分析物的差异问题。
4、处理过样品与新鲜病人标本间的基质效应(第二层次基质效应)
采用真实的病人血清作“标准”(校准品),校准检测系统,再由该检测系统去检测病人血清,以此克服标准液和真实血清间的基质效应。但是,该“标准”血清内也含有要检测的分析物,它的浓度为多少?需要采用检测系统先检测。不同的检测系统(方法学、检测程序)对该“标准”血清的检测结果不同。因此,校准品的定值一定与检测它的系统有关。即:校准品的值依赖于检测系统;也一定没有各个检测系统通用的校准品。
“处理过样品”(Processed Sample)的名称是因为:1)新鲜的原血清无法长期保存,必须对它进行防腐处理。或是加入防腐剂、或是冷冻干燥;2)冷冻干燥处理后使血清内部分内含脂蛋白变性,复溶液体变得浑浊;而且这样的浑浊随着冻干血清保存时间的延长越来越严重。对使用带来困难;3)为了尽可能使复溶的冻干品变得清晰,大多厂商在制备中,先行去除α-脂蛋白,又经透析等处理;4)原有混合血清内各个分析物浓度不理想。对于过多的分析物采取透析或沉淀、吸附等处理;对不够的分析物则采用加入各种非人来源的原料,使其达到“理想”的水平。但是,这样处理后的原混合血清就与新鲜血清样品间产生了新的基质差异。
关于校准品、控制品的添加物(示例),有公司提供的信息,以下在校准品和控制品中,前面为分析物名称,后面有下划线的为添加的物质:
酸性磷酸酶 人前列腺(重组)
ALT、AST、LD 猪心,GGT 猪肾
白蛋白、胆固醇 牛血清
ALP 人胎盘(重组),淀粉酶 猪胰
胆碱酯酶 人血清,肌酸激酶 兔肌
GLDH 牛肝,脂肪酶 人胰重组合
转铁蛋白 人Cohn Ⅳ组分
甘油三酯 鸡蛋黄,碳酸氢钠。
因此,各种内部质量控制和室间调查用的控制品(controls),和校准品(calibrator),都经过加工处理,例如:冰冻、冷冻干燥、加稳定剂、添加某些分析物等,都是处理过的样品(processed sample)。它们都不是日常检验的新鲜病人样品。在平时,检测新鲜病人样品时不常见的偏移(bias),在检测处理过样品中却常见,因为在处理过样品中有新鲜样品没有的基质变化。这是新鲜样品与处理过样品间的基质差异产生新的基质效应。
临床检验结果的正确度是检验可靠性的重要方面。为此,政府机构强调实施室间质量评估计划(proficiency testing or external quality assessment),作为评价各实验室正确度的依据。但是,现有数据说明,简单地从室间评估数据说明正确度不一定可行。下发的各种室间调查用的控制品(controls),都经过加工处理。例如,冷冻、冷冻干燥、加稳定剂、添加某些分析物等,都是处理过的样品(processed sample)。这亦包括室内控制用的控制品和校准品(calibrator)。它们都不是日常检验的病人新鲜标本(fresh specimen)。由于这些基质效应,以室间调查来评价检验正确度,若不重视会导致不正确结论,甚至会带来不应有的行政处理。
基质效应涉及各个检验专业项目,表现有所不同。在分析中,仪器设计、试剂组成、方法原理、控制品、校准品、室间调查材料的组成和处理技术是产生基质效应的因素。它们间的互相作用又使基质效应变得更为复杂。对这类基质效应的观察,是了解某检测系统(包括方法学、仪器、试剂、操作程序等)在检测处理过的样品时,和病人新鲜样品结果间具有不同的偏移大小。但是,只用一种检验方法检测处理过的样品和病人样品标本时,无法看出这种偏移。
只有通过方法比较实验,假定某参考方法对病人新鲜样品和处理过的样品均能测出可靠结果,若被评价方法对新鲜病人样品的检测结果和参考方法比较具有的偏移明显小于两方法对处理过样品对比具有的偏移,即可说明该方法在检测处理过样品时具有的基质效应。显然,所有评价基质效应的实验都是相对的。基质效应是对产生误差的解释,还不能阐明效应的真实机制。
EP-14A2文件的实验方法可以使实验室知道:使用的校准品、控制品或室间调查样品等的“处理过样品”,在实际使用中,它们的表现是否与新鲜病人标本“一致”,即是否具有互换性。但是,究竟在实际应用中,我们是怎样做的?这需要弄清楚。大致上,处理过样品的产品可以分为:正确度控制品(物质);校准品;一般控制用的控制品和室间调查品。为了克服纯标准液与新鲜病人样品间的基质效应,使用与新鲜病人血清有明显基质差异的处理过样品,作为某个检测系统的专用校准品。实验室应该完整理解和正确使用“校准品”。
临床重视的是如何确保病人样品检测结果的可靠性。但是,不同试剂、仪器的组合对处理过样品的检测结果都不一样。被用作校准品的处理过样品,实验室还必须使用它去校准检测结果的可靠性。如何为校准品定值成为了一个关键!
5、校准品的定值
为了确保实验室对病人样品检测结果的可靠性,首先有效的做法是:公司必须固定仪器、试剂、与校准品的固定组合!第二,公司必须向国际公认的参考实验室申请,委托他们使用国际公认的参考系统(参考物质与参考方法)为一批新鲜病人样品确定参考值。然后,公司以这些血清的检测参考值结果为准,在自己的仪器、试剂、校准品固定组合的检测系统上,以这些血清作为标准,经过反复检测,不断“调整”公司校准品的值,使该校准品的“调整值”对公司的检测系统校准后,对这批具有参考值样品检测的结果与参考实验室对这些血清给出的参考值一致。此时,该校准品的定值被确定下来。
上述的校准品定值是在方法学比较中,经过反复比对、调整得到的。因此,校准品的定值只能为被“调整”出来校准值的检测系统服务!所以:1)仪器、试剂、校准品和操作程序组合的检测系统,是第一位重要的!不可任意更换!2)校准品的定值专为检测系统服务的!
所有市售的校准品都只能为公司的检测系统服务,专用于该检测系统。只有这样的校准品才是真的。市场上有些公司的试剂盒也有校准品供应。须注意:任何校准品的专用性,如果提供者承诺任何仪器均可以使用的,如果只有一个校准值的,一定是问题。
6、由试剂引入的第三层次基质效应
上述的第一层次基质效应和第二层次基质效应讨论的,均为病人样品内的基质与纯物质的水溶液或与处理过样品间基质差异引起的基质效应问题。没有涉及样品参与反应时,由试剂引入的基质效应。其实,引入基质效应的情况非常复杂。试剂在参与反应时也引入了基质效应。
试剂必须参与反应方能得到检测结果。因此,不同批号引入的试剂,因其内含各个试剂成分的细微差异而造成的分析环境变化,是不同批号试剂检测结果不同的基质效应。
试剂厂商在生产成批试剂时,尽管使用了现有最好的设备。但是,试剂需要控制各个组分的准确含量,并且确保加工处理的各个环节可重复。大规模生产采用的称量可以很精确,但是,要配制成精确量的容量设备缺如。唯一可行的是以称量替代容量。对配制量达到数千升时的称量,在度量容量上使用称量方式引入了很大的误差。这仅是成批试剂配制时引入的一个问题。
其他诸如:各个试剂组分原料批间差异、调节pH的误差、离子强度差异、每批抗原来源和纯化差异、抗体来源和本身的免疫反应亲和力等差异、表面活性剂分子大小等的差异等,均会严重影响每批试剂内含组分的差异。配制中的搅拌速度、分装时间的长短、分装使用设备的清洗和灭菌问题、分装后的充惰性气体完整、冰冻干燥时各瓶试剂在冷冻箱内的位置等,也都会影响试剂质量。因此,试剂厂商提供的试剂批间一定有差异,只是在临床化学等产品上表现不明显。但是,对于免疫试剂,则批间差异表现很突出。
各批试剂与同一个人新鲜样品内的分析物反应时,各批试剂间的反应会有差异,这是样品参与反应的差异,即基质效应。同样,各批试剂对于“校准品”和“控制品”这些处理过的样品的反应更会有差异,它们与新鲜人血清间在参与反应中的差异,更是新鲜人血清与处理过样品间的明显基质效应。
为了确保同一个病人样品使用不同批号试剂得到的结果一致,在确认不同批号试剂的基本分析性能下,惟一有效的方法是以具有参考值的人血清为依据,调整每批校准品对于每批试剂的校准值。然后,再按照溯源性要求,以常规新鲜样品再次进行参考方法与某批号试剂加上为之调整校准值的校准品的检测系统,进行方法学比较,符合要求后方可让该批号试剂上市。这是为了克服客观存在的基质效应,才必须采取的措施-每批校准品对于不同批号的试剂具有不同校准值。
为了真正保证每批试剂可以对相同病人样品得到一致的结果,一些公司在免疫产品中的标准化是一个非常有效的做法。基于免疫项目的广泛和参考物质或参考分发的缺乏,在为免疫项目检测系统校准中,与临床化学项目相比,不仅强调建立一级校准品(master calibrator),而且也必须确立与之配合的一级试剂(master reagent)。
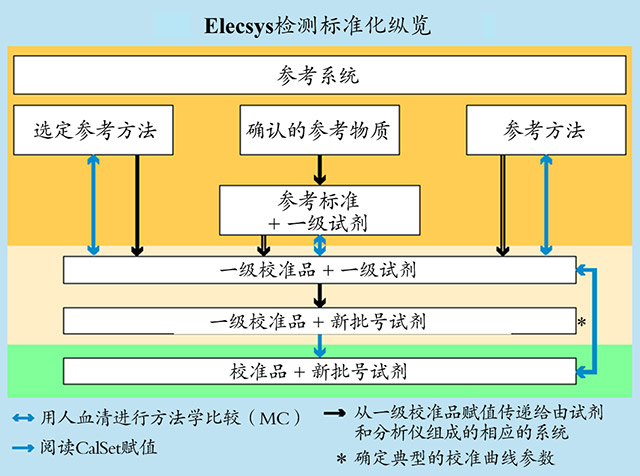
罗氏产品对不同批号免疫产品进行标准化的示意图
为了确保每批试剂对同一个病人样品的某项目分析物的检测,可得到相同的结果。通过标准化,对每批新试剂必须配合每批试剂专用的校准品的定值(即使是相同批号的校准品,对不同批号的试剂必须具有相应调整的校准值)。由于参与检测的试剂和样品反应中的基质效应,必须对每批试剂配合专用的校准品值,确保每批试剂对相同病人的检测结果得到一致的结果。
因此,相同批号的控制品,使用不同批号(相同厂商产品)的试剂一定会得到不同的检测结果。所以,按照质量控制要求,每换用试剂批号时,必须重新设定控制均值和标准差。
7、总 结
基质效应是当今临床实验室每天面临的现实问题,它越来越被临床实验室重视,应该予以充分理解和重视。一定不要忘记:任何项目(分析物,更正确的是被测量)被要求结果的可靠性,这个结果是新鲜病人标本的检测结果!不是任何控制品或室间调查品的结果。因为它们与新鲜病人样品间的明显基质差异。在可能的情况下,实验室应不使用纯标准液校准检测系统。采用检测系统专用的校准品确保检测质量。没有通用于任何仪器、试剂、操作程序的校准品。重视每天的质量控制,始终将病人结果可靠性放在实验室工作的第一位。
因此,必须使用新鲜病人标本作为了解结果可靠性、一致性的根本。懂得和理解检测系统的概念和重要性。并在日常工作中坚持使用固定的检测系统对病人标本进行检测。必须使用与检测系统配套的校准品。不要忘记校准品是“处理过的样品”。它的校准值只能用在固定的检测系统上!决没有通用的校准品(即一个校准品,只有一个校准值;却可以用于任何组合的仪器、试剂上)。理解不同批号试剂,需要对同一批号的校准品给予不同校准值。因此在换用试剂批号时,必须同时更换校准品或校准值。控制品也是“处理过样品”。常用的控制品与新鲜病人标本间没有互换性。所以,每天的质量控制只是不精密度(即重复性)的控制。没有正确度的控制。换用试剂批号时,也需要注意及时比对,调整控制品的均值。期望始终将临床的需求和病人利益放在我们临床实验室工作的第一位。
《临床实验室》:前面的介绍您一直强调检测系统的校准,您能介绍下什么是临床检验的检测系统?
冯仁丰教授:我们必须重视检测系统,什么是临床检验的检测系统?完成一个项目检验所涉及的仪器、试剂、校准品和操作程序等的组合,为检测系统。若是手工操作,还必须包括具体的操作人员。实验室只有自始至终地坚持不更动每个检测项目使用的检测系统,才能确保实验室每个项目的检测结果具有可比性。
什么是ISO 17511指的测量系统或测量程序?在文件引言中指出:生物样品中量的测量要求参考测量系统,包括:确定生物样品中分析物,以及测量结果的预期临床应用;确定人样品中选定量的参考测量程序;适用于选定量的参考物质,如一级校准品和可以替代的二级具基质校准品。
对样品的检验,必须使用仪器、试剂、校准品、和操作程序组合的检测系统。没有检测系统的固定组合,也就不可能实现样品检验结果的可追溯性。ISO 17511的要求是建立在已经具有良好性能的检测系统上,论述检测系统如何实现对样品检验结果的溯源性。
因此,单纯的试剂盒没有说明指定在什么仪器上、也没有校准品的,无法证实它对病人样品检验结果的溯源性。单一的仪器,没有说明使用什么试剂盒,也没有指定的校准品,也无法证实任何溯源性。
王义夫之所以能够得到世界射击冠军,他使用固定品牌与型号的气手枪;使用与枪配套的品牌和型号的子弹;使用固定的校准程序;经长期练习形成的射击程序。这就是王义夫获得世界冠军的射击系统。可是,目前大多临床检验科的认识是,一枪定天下的关键是枪,所以要一把世界闻名的气手枪;子弹只要能用就可,哪家便宜用哪家;对枪的校准视射击效果而定,凭经验估计;只要凑合能打,关键是人的本领!因此,随意更换使用的试剂和校准品,没有固定的检测系统,是当前大多临床实验室的现实表现。难以确保对病人样品检测结果的可靠性。
《临床实验室》:现在国内临床实验室也越来越重视实验室质量控制,请您能谈谈质量控制及其重要性?实验室应该如何开展质控?
冯仁丰教授:实验室开展的质量控制实际上是控制了检测系统的检测质量,上述示例清楚地说明了,要得到可靠的、具有溯源性的结果,必须固定实验室使用的检测系统的组成!千万不可任意更换!没有检测系统的概念,今天在做的检验无法说明采用检验使用的系统的质量,何来检测结果的质量!实验室主任必须对实验室使用的所有检测系统质量负有不可推卸的责任!下面我从三个部分介绍下如何进行质量控制:
1、什么是质量?
质量管理应理解为管理质量;质量评估应是评估质量;质量保证应是保证质量;质量控制应是控制质量。上述的每个词语都涉及质量。实验室必须说明:什么是你实验室的质量?这个质量涉及两方面:一是实验室确定的质量目标;二是实验室目前现有的质量水平。什么是临床实验室的质量目标?大多实验室中很少理解。没有质量目标,那么质量控制在控制什么质量?我经常在解释质量控制时,说得很通俗,天天、月月、年年一样,就是在控!其实,这是对目前国内大多实验室没有确定质量目标下,仅仅以现有的操作质量水平为准下,只要每天都“差不多”就算在控了。这是实验室认为,目前这个分析物的检测质量水平是可以的。期望保持并不要出现比这样的质量更差的水平。其实这就是实验室具有的操作水平(State of the Art)。具体表现为误差水平。问题是,临床实验室是否对这个操作水平的现有误差水平,具有文件记录?有无具体的误差大小的内容?没有!
涉及检测质量的几个大类
分析前的规范:收集病人样品。包括病人准备、标本管患者信息完整无差错、采集标本时病人的姿势、标本运送和储存要求、分离血清血浆的及时和到位、样品从离体到检测时间的限制等,是否都有规程?
第二是检测系统的选择、分析性能的评价或验证;仪器的定时保养;仪器重大保养后、试剂批号更新后的系统再次性能验证。这些是否都建立和实施了规程?开展QC问题:有无控制品的复溶、系列处理的操作规程?包括:复溶规程、分装规程、冻融规程、建立均值和标准差规程、有无试剂批号更换时重新确认均值和标准差的规程、进行质量控制要求记录内容的规程、失控处理规程等。千万不要将开展质量控制视为特殊内容,将其特别对待!越是以平常心态去处理,越反映实验室的实际状态下的质量现状。
2、开展每天质量控制的前提
实验室是否具有了检测系统的牢固概念?是否对检测系统的分析性能进行了确认或验证?是否实验室完全按照自己编写的操作规程,如实进行病人样品的检测?有无进行质量控制的操作规范?实验室的所有人员都经过了QC的培训?
ISO 15189 2012中第5.5.1.1节总则中:实验室应选择与其用途经过确认的检验程序,应记录检验过程中从事操作活动的人员。每一个检验程序的规定要求(性能特性)应与该检验的预期用途有关。注:首选程序可以是体外诊断医疗器械使用说明中规定的程序……第5.5.1.3 检验程序的确认:实验室应对以下来源的检验程序进行确认:a)非标方法;b)实验室设计或制定的方法;c)超出预期范围使用的标准方法;d)修改过的确认方法。
方法确认应尽量全面,并通过客观的证据(以性能特征形式)证实满足检验预期用途的特定要求。注:检验程序的性能特征宜包括:测量正确度、测量准确度、测量精密度、分析特异性、分析灵敏度、检出限和定量限、测量区间等。在美国的CLIA’88法规中,规定定量检验的分析性能为:精密度、正确(准确)度、检测范围、分析灵敏度、分析特异性和参考范围。
这些也是定量检验的质量水平的体现。检验总有误差。所谓质量就是这些分析性能表示的误差大小。公司产品说明书中各个性能指标就是公司产品质量水平的体现。保持和改进这些性能水平是质量管理的重要内容。
3、分析性能的确认
临床实验室使用的检测系统,目前绝大多数均为商品,来自制备厂商。厂商为了让实验室相信,它们的产品可以做出令临床满意的检测结果。因此,对实验室需要的六个分析性能(精密度、正[准]确度、分析范围、分析特异性、分析灵敏度、和参考区间),采用国家或国际的实验文件(如美国的CLSI)进行实验,逐一建立各个分析性能。这样的过程是分析性能的确认(Establishment或Validation)。当实验室采购了某个厂商的固定检测系统后,在进行检测患者样品发出报告前,实验室一定要验证:厂商提供的分析性能是否真实。所以,实验室必须亲自动手进行必要的实验来验证这些分析性能。验证性能的目的是双向的:1、厂商产品的真实可靠;2、实验室是否能做出符合产品分析性能的检测结果,说明实验室掌握了该检测系统。
目前,实验室懂得和知道对检测系统性能的验证。但是,最大的问题是:实验室在新检测系统引入实验室后,厂商负责安装和调试外;也包括了对检测系统性能的验证实验。实验室只是在验证实验报告上签字完成了这个验证!这是厂商安装了仪器后规范行为!不是实验室自己的验证过程!可是一旦使用中认为有问题了,即刻通知厂商解决问题!所有一切全部由厂商承担!
因此今天的实验室变成:实验室做检验、收费进医院和实验室;有问题厂商负责!实验室几乎对检测质量不负任何责任!实验室的责任何在?这样的扭曲状态遍布全国! 在实验室内,实验室人员只是上机操作员,较全面了解每个检测项目的很少;一问三不知!完全丧失了管理中要求实验室验证性能的内涵!尤其是,实验室为了节省成本,在购买检测系统时,往往单独买一个仪器;然后在众多的试剂盒市场中去挑选最便宜的、关系最好的厂商,自行搭配组合成“自建”的检测系统。而且还经常在换试剂来源!因此,这样的实验室在进行患者样品检测前,没有资格进行所谓分析性能的验证,而是必须像检测系统厂商那样,去建立检测系统,即确认新组合检测系统的分析性能是否符合临床需求。
国内有那么多的试剂厂商,由于国内很多的扭曲做法,加上国家药品监督机构的错误行为,认为使用了“具有溯源性”的校准品后,我们所有的结果都具有了溯源性!却不懂得:校准品的校准值只是检测系统固有的!决没有所有检测系统共有的校准品!今天的国内检验界采用的所有试剂盒,全部使用了罗氏或Randox的校准品!完全丧失了检测系统的可靠性!太悲哀了!!
《临床实验室》:国内临床实验室在质控上仍处在起步阶段,还要多多借鉴国外实验室在质控上的经验,您能简单介绍下发达国家的临床实验室在QC上做出的努力么?
冯仁丰教授:下面跟大家一起回顾下世界临床实验室QC之路:
1、世界临床实验室QC的进程,从单纯无序的QC进入了正规全球接受的Westgard多规则QC;不断更新的Westgard多规则QC;与分析性能Sigma水平结合、以临床需求为目标的Westgard Sigma规则的QC;考虑QC检测风险的连续检测 “病人标本数限定区间”QC安排方案。
2、上世纪70年代Westgard的认识和行为
上世纪70年代Westgard强调了分析性能的重要性。1981年,Westgard提出的多规则,应该是以控制在 (2Σ)水平为基础建立的。以12S为警告规则也就很正常了。1982年,Westgard发表了什么是质量控制的质量,开始强调了,临床实验室的质量应以满足临床对病人的诊断和疗效的观察为目标。否则,质量控制没有意义。
3、Westgard传统和现代的多规则,是上世纪80年代起至今的重要控制方法。
为全球临床实验室开展的每天QC,从理论到实践奠定了扎实基础。可是,只是实现了以实验室现有的操作水平为目标的QC。在Westgard之前,尽管也有不少论述临床实验室开展质量控制的专著和文献。但是究竟每批检测需要做几个控制品、应该如何选择合适的控制规则,怎样才算是在控和失控?失控后该怎么处理?在开展质量控制前的基础要哪些?等等都说不清。如何从控制理论上转化为实际可操作的控制方法。对这些做出最大贡献的,就是Westgard。
因此,毫不夸张地说,Westgard是当代临床实验室质量控制的开拓者和奠基者。时间过得真快,Westgard发表的多规则控制程序的文章距今已经38年了。“Westgard多规则”闻名全球。Westagrd当初就是想解决临床实验室在每天质量控制中,如何使每个检验人员可以在判断失控上有一致的认识。由于该控制程序概念清楚,很快就被仪器厂商和临床实验室人员广泛接受。国内也几乎在1981年后开始宣传推广,该程序已在全国各个临床实验室普遍采用。
Westgard对QC的贡献:1)质量控制控制什么?控制误差。但从理论上,提出误差分为检测系统稳定状态(固有)误差及除此之外的不稳定状态(外加)误差,质量控制只能控制外加误差;2)Westgard以概率理论发展了各种控制规则的误差检出特性曲线。由曲线反映规则对外加误差检出的灵敏度;以及把固有误差误作假性报警的可能性,即误差检出的特异性;3)发展了多规则程序,由计算机自动检索,大大提高了质量控制效率。使失控误差检出率大大提高,又极大地减少了假性报警的概率;4)要使检验结果真正符合临床要求,必须对检验方法作严格的评价。Westgard从理论和实践上提出了完整的方法学评价实验及总误差概念。
4、Westgard多规则的遗憾
Westgard多规则确实推动了全世界临床实验室的QC。但是,Westgard多规则并没有解决以质量目标作为质量控制的手段。也即,还是以实验室具有的现有操作误差水平(State of the Art)为控制目标。它满足了实验室认为的质量,即目前分析物的检测质量水平是可以的。期望保持并不要出现比这样的质量更差的水平。还有,长期以来,Westgard一直没有关注:究竟每批病人样品检测数为多少,可以确保检测质量。也即,进行QC检测可确保真正在控的病人标本数为多少?近几年来,Westgard推出的以临床需求的质量为QC的目标,开展了6Σ控制方法。但还是回避了每批检测病人标本数是否需要控制的大问题。
5、Dr Parvin关注实验室的质量控制:应该将QC做法的设计确保病人检测结果的可靠性,不是仪器的运行是否正常。
1)他强调了今天自动化分析仪上开展的质量控制,只是“控制”了仪器是否正常,不是关注在仪器上被检测的病人标本的检测结果的质量。
我的学习体会:上世纪50年代临床实验室是手工操作年代。当时被检测病人标本、标准液、空白液和控制样品都在一个试管架上。完全依靠操作人员的手工操作完成检测。在这样的情况下,由于手工操作的做法(例如,分别取样后,需要加入各个试剂时,是对所有样品一起顺序假同一个试剂。再加第二个试剂等),所有被检测的病人结果和控制结果互相关联。因此,控制结果是否在控可以说明这试管架病人标本的检测结果是否可接受。
可是,在自动分析仪上对样品的检测,因仪器的设计为分列式,所有每个被检测的样品都是被仪器独立地检测完成的。因此,控制结果在控,说明该控制品仅在被检测的时间点是符合要求的;但是它无法证实,以后紧接着的病人标本是否如控制品那样被完整地检测。也许就在该控制品检测后,出现了问题造成检测误差或仪器的故障,使以后的病人标本检测结果出现问题。要看这个问题所致的误差大小,是否大至下一个控制品检测被发现,出现失控表现,方使实验室知道出现失控了。
但是究竟这个问题出现在什么时候、究竟问题有多大?实验室究竟要对多少病人样品进行重新检测?这样的问题一直是现今各个实验室在质量控制中的困惑。因此,Dr Parvin认为,必须要将质量控制关注的重点放在检测的病人标本结果的质量上。质量控制策略的设计要关注如何确保报告的病人检测结果质量。国内能够做QC已经不错了,至于失控下几乎没有对标本重新检测,问题更为严重!
2)从统计学上,认为QC在控表现使报告的病人检测结果可靠的可能性很大。平时一直以均值加减2SD作为是否有问题的判断限。只要控制值在加减2SD之内,实验室即刻判断该批检测结果在控,没有问题。可是从统计上,这只是说明有95%的可能性,所有的检测结果在控。但是,还有5%的检测结果会超出加减2SD!这意味着,每100个病人检测结果中有5个检测结果不正常!这个比率不小!今天如果允许出问题的可能性需要保持在1%以下,那么这样的做法就是今天传统的质量控制没有解决的问题!因此,Dr Parvin坚持要将质量控制关心的重点,从关注仪器是否在控,转变为关心每个检测病人结果是否在控。我个人认为这是质量控制认识和做法上的重大转变!要关心病人结果是否“可靠”,而不是仪器是否运行“正常”!
Dr Parvin的观点虽然非常有道理,可是如何具体设计和操作,没有一般实验室可以看到的资料,除非去购买Bio-Rad的专用软件(Mission Control),这为实验室的实际应用有巨大的困难!Dr Parvin的认识,被Dr Westgard接受,改变了Westgard一直未能重视分析批量的观点,完全按照Dr Parvin“限定病人标本数的QC策略”,加上Westgard采用Sigma度量选择质量控制方法,写出了Westgard最新的QC策略。
6、美国临床和实验室标准委员会(CLSI)的C24-Ed4标准文件“定量检测程序的统计质量控制:原则和定义”,是Dr Parvin为主席编写的。为消除患者风险,在新的CLSI为SQC导则(C24-Ed4)上,推荐了“限定(病人标本数) [bracketed]”的统计质量控制(SQC)。限定(病人标本数)的SQC,要求在检测限定的一组病人样品前和后,均要进行QC检测。还要为检测中出现影响检测质量的关键点,必须进行QC检测,确认没有问题(关键点QC)。既要保持质量,还要有助于高产出分析系统的连续操作结果进行相应报告。
7、限定区间QC的意义:每天质量控制必须在检测的开始起就有QC,然后按照要求,在一定病人标本数后再进行QC检测。前后QC间限制了可检测的病人标本数。称为“限定区间QC的安排”即“限定(病人标本数)区间[bracketed] QC”,因为一个“限定区间[bracketed]”的开始和最后QC的结果,用于确认了,在“限定区间”内检测的病人结果是可接受的。实验室应随同限定区间内SQC事件,发送和报告病人检测结果。
Westgard建议的多步骤SQC:在更多地考虑费用有效性下,可考虑一个多步骤的SQC设计,即“一个控制程序涉及两个或更多不同的设计,在合适时从一个方式转换为另一个方式”。例如,一个多步骤控制程序可具有一个“启动”的设计,用于初始的检测;一个“监视”设计,用于在开始后的常规运行;而一个“回顾性”的设计可用于评审在一个较长的周期内;不是一个单批检测的控制数据。
《临床实验室》:能请您简单分析下当前国内临床实验室的质控现状么?
冯仁丰教授:在过去的近40年里,临床实验室的检测手段发生了巨大的变化。随着自动化的不断发展,其中有仪器的自动化进步和智能化;以及检测方法学的发展,与自动化配合,分析性能得到了极大的提升。因此,强烈地意识到,使用分析性能优良的检测方法,开展QC也变得越来越好!中国也一样发生了天翻地覆的变化!上世纪的1983年,在全国检验学会第二次年会上,厂商展出了几台自动分析仪,引起了与会同道的极大兴趣。接着,多家公司开始在国内推广销售它们的自动分析仪。日立是在国内第一个推出它们的分析仪的。它不准罗氏前身(Boehringer)在中国推出检测系统。很快,国内多个实验室有了分析仪。迫切需要试剂配合,推动了国内自行开发或引进试剂。阴差阳错地,我国临床实验室开始了自行组合仪器和试剂,用于检测病人样品。
至今我国难以计数究竟有多少不同仪器和试剂的组合!第一个引入校准品的是德国Diasys。尽管以后大型诊断产品公司推出了完整的检测系统,可是自行组合的做法一直在持续。而且,从国家批准检验收费的好处中,拼命节省试剂成本,严重损害了病人利益。因此,国内先天不足的自动化发展,加上国内非常讲究检测付出的成本!再好的仪器,总是在全国各地有着无限的国产试剂仪器运行!如此杂交品种繁多“检测系统”,在国内为我们老百姓进行真实样品的检测!检测质量是一个最最重要的大问题!对仪器可靠性的崇拜远远高于对试剂的信任!只要仪器好,一般般试剂都可以应付!究竟自行组合的检测系统的分析性能是否符合临床要求?尽管不断地宣传,但是,被基层实验室认可重视的非常非常可怜!
买仪器就像买一辆汽车,试剂就像开汽车需要的汽油!只要能用,检测结果出来,什么试剂都可以用!基层院长都已经看到了自动化仪器对病人标本处理的能力!因此,为了让医院的收益更好,亲自选择自动化仪器、并要求实验室在几天内马上出报告的例子,举不胜举! 但是,在选择试剂上的招标上,许多都是院长亲自“钦点”同意的!原则就是越便宜越好!
在这样的情况下,检测质量低下是必然的!至今,国内还有许多实验室根本没有质量控制,照样发出病人检测报告!有的买一点控制品,在实验室自己也犹豫自己的检测结果时,拿控制品当做宝贝,检测一下,差不多的就可以了!但是,中国在质量控制上最严重的问题远远不止这些!可以肯定地说,因为部分实验室在争取通过ISO 15189的实验室认可,所以按照要求,重视了检测系统分析性能的验证!也知道要做好所有记录!可是,就是没有任何关于疑似被失控影响的病人标本,必须重新检测的明确规定!
前面介绍Westgard控制方法在逐渐深入,这是期望将质量控制越做越好!不知道是国外与国内认识上的差距,或者是我们对老百姓需要准确可靠检测结果的尊重上看法不同,已经被怀疑质量有问题的病人标本为什么就不被大家重视去重做?我们不是政府官员,我们与病人一样都是一般般老百姓!为什么我们在出现失控问题后,会对标本重做如此淡漠?Parvin指出了在全自动分析仪上,进行的质量控制,实际上不是对病人标本的控制,是对仪器运行是否正常的反映!因此,他专门研究了即使在控下,依然还有病人检测结果可能处于的风险!强烈呼吁要缩短两次控制间限定标本检测个数!因为,这样一旦出现失控,可以重做检测的病人标本数不会太多!Westgard接受了Parvin的风险观点,遵循C24-A4的精神,形成了上述的最新做法!这样的做法,在国内面临最大的阻力,就是:难道我们一定要对“失控”的标本去重做?如果我们不再重视这个问题,所有的介绍和推动都是空话!
《临床实验室》:听了您的介绍我们越发认识到实验室质控的重要性,对于中国临床实验室质控未来之路,您有何建议和期待?
冯仁丰教授:我们该做什么?对Parvin的认识和Westgard的推动,我们需要去努力追赶。可是当务之急是,要推动临床实验室的人员要有良心!要认真处理已经被认识可能有问题的病人标本的重做!没有良心,昧着良心,避而不见是一个处理方式。那么,我们可以偃旗息鼓了。还要做什么质量控制?因为真的是做QC等于没有QC的作用! 我们要从头做起!要反复宣传完成检测的检测系统概念!鼓励实验室一定要使用分析性能良好的完整检测系统!这是实现检测质量的头等大事!必须亲自动手进行分析性能的验证!
Westgard近期在他的文章中,采纳了西班牙临床化学工作人员Yago和Alcover的文章,提供了极其有启发性的计算图表,可以选择简单的质量控制规则,可获得每100个样品分析批中相应很低的有缺陷结果的频率。作者建议,不要使质量控制过于复杂,尽可能采用简单的、甚至是很老的计算图表,能够发挥作用就好!而且他还依据Dr. Greg Miller思路,实验室首先要做好检测系统的选择中,在大型实验室应该在各个实验室内尽力使用相同的检测系统。重点就是控制精密度。在此情况下,可以忽略偏移在计算Sigma中作用,可以提高Sigma值!但是,所有一切都是建立在失控一定重做之上的!
在国内目前的情况下,立即推广Westgard的限定病人标本数的质量控制做法,过于先进了。 完全可以从经典的Westgard多规则起,真正地在临床实验室做起来!不在乎知道这些控制规则,对误差检出能力不够的可能性!现在的问题是,即使这样的控制出现失控,我们实验室没有任何措施去支持病人得到可靠结果呀!何况,最新的Westgard第5版上依然还在介绍他的多规则!
考虑到让实验室在出现失控后,除了寻找原因纠正问题外,还应该对出现失控起到前一次在控的期间内,病人标本给予重现检测,以期得到可靠结果。因此,建议每200个标本为一个限定数(可以讨论)。再多一些重做时病人标本数太多;过少的,则实验室感觉控制检测太多。一定坚持每天一开始,必须先进行QC检测!确保没有问题!依然绘制控制图,了解目前控制现状,以及以往的控制情况。
努力寻找真的对病人满怀感情,对失控标本重做的临床实验室,把他们的先进事迹进行重点宣传,鼓励大家向他们学习!突出宣传临床实验室必须爱我们的老百姓!不扭转失控标本不处理的的坏事,中国的临床实验室没有希望了!我们还有什么面目向全世界做出交代!我是在冥思苦想中,对我们临床实验室目前对不起老百姓的表现,提出了挑战!事情总有开始!必须百折不挠!期望实验室同道去努力推动临床实验室真正关爱老百姓的具体作为!供参考!无论如何,国外的实验室每天的检测还是一定有QC!而我们至今还有那么多的实验室没有QC,照样出报告!还是要有良心!要对得起老百姓!将每个前往我们实验室进行检验的每个病人,视为我们的亲人!
来源:临床实验室
我要留言














