文章来源:中华检验医学杂志, 2024,47(09):1013-1026.
作者:中华医学会检验医学分会临床微生物学组
基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)技术在微生物学检验中具有检测速度快、鉴定准确率高、检测成本低、检测通量高、可鉴定菌种类型广泛等特点。随着微生物质谱技术的快速发展和广泛应用,MALDI-TOF MS的规范化使用及管理、技术要点等内容亟须广泛普及,以更好推动该技术在临床微生物学实验室的高效使用。专家组通过对国内外相关指南共识及文献的阅读和讨论,结合我国MALDI-TOF MS的临床应用现状,就临床实际工作中存在的常见问题,对影响或决定MALDI-TOF MS技术规范化使用、结果准确解读、科研探索等方面存在的问题进行了反复和深入的讨论,最终形成本共识。随着实践经验的不断总结和临床研究的不断深入,编写组将不定期对共识内容进行更新和完善。
基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)是一种新型软电离有机质谱技术,用于分析生物分子(如DNA、蛋白质、多肽、糖类等)和大分子量的有机分子 [ 1 ] ,使得微生物蛋白质指纹图谱进行菌种鉴定成为可能。随着MALDI-TOF MS仪器临床使用日渐广泛,越来越多的临床问题需要规范。本专家共识旨在对日常使用MALDI-TOF MS进行病原微生物鉴定的常见问题给出详细建议,仅供临床微生物学实验室参考。
本专家共识制定过程:本共识由郝晓柯教授、应斌武教授和鲁炳怀教授牵头,确定执笔专家和汇总专家,召开共识启动会,讨论会和定稿会。搜集临床问题,专家讨论归纳出22个问题,执笔专家分别回答擅长问题,汇总后专家会议讨论确定内容,并最终确定13个实用性问题。涵盖了MALDI-TOF MS应用的“概述、标本制备、结果分析与展望”4部分。执笔专家通过大量文献调研并结合使用经验分别对共识内容进行了撰写和互审,形成“共识讨论稿”。通过函审形式由编写专家形成了40余版“共识修改稿”。在此基础上,专家组共同凝练出13个实用性问题并形成13条推荐意见纳入共识讨论内容中。同时制定了共识调查问卷,针对每个推荐意见征集专家建议,通过函审形式调查。调查结果的统计分为推荐、有条件推荐、不推荐和弃权。推荐和有条件推荐统计为推荐意见,征集到47位专家的建议统计后形成了最终的推荐意见。综合评审和调查结果,执笔专家形成“共识审阅稿”,同时由审阅组专家进行审核。最终结合专家反馈的建议和意见对文章完成修改后形成本共识。
01 概述
问题1 MALDI-TOF MS进行病原微生物鉴定的优势和局限性有哪些?
推荐意见1 推荐MALDI-TOF MS作为细菌、酵母及酵母样真菌鉴定的首选方法之一。
MALDI-TOF MS用于病原微生物鉴定,与临床常用微生物鉴定方法包括菌落和镜下形态学、生化、免疫学以及基因测序相比,具有明显的优势 [ 2 , 3 ] 。
1.快速、简便、通量高:前处理及上机操作步骤操作简单,短时间内即可完成多标本检测。
2.准确度高:MALDI-TOF MS的鉴定准确率为90.0%~95.0%,显著高于微生物生化鉴定系统 [ 4 ] 。MALDI-TOF MS检测的是保守且具有种特异性的核糖体蛋白,对近缘菌种的区分能力较传统方法更强,尤其对有重要临床意义的菌种鉴定有明显优势。例如对凝固酶阴性葡萄球菌和引起心内膜炎的HACEK群菌种 [ 5 ] 。
3.鉴定范围广:相比生化鉴定方法,MALDI-TOF MS能鉴定更多的临床菌种,除了常见细菌,还适用于分枝杆菌、酵母及酵母样真菌、丝状真菌、专性厌氧菌等 [ 6 ] 。根据行业标准《医用质谱仪第2部分:基质辅助激光解吸电离飞行时间质谱仪》(YY/T 1740.2-2021),商业参考谱图数据库应包含≥700种微生物 [ 7 ] 。
4.检测成本低:试剂耗材(靶板、试剂、校准品)少、成本低。
尽管MALDI-TOF MS有许多优势,但也需要注意该技术在微生物鉴定方面的局限性,主要包括以下几个方面:(1)部分近缘菌种鉴定易混淆。近缘菌种由于核糖体蛋白的内在相似性,使得谱图难以区分,包括但不限于大肠埃希菌/志贺菌属、蜡样芽孢杆菌复合群、肺炎链球菌和缓症链球菌群、洋葱伯克霍尔德菌复合群、鼻疽/类鼻疽伯克霍尔德菌、无色杆菌属、弗劳地柠檬酸杆菌复合群、阴沟肠杆菌复合群、沙门菌属、结核分枝杆菌复合群 [ 6 ] 。随着数据库的扩展和算法的改进,区分以上近缘菌种的能力会逐步改善。各制造商的易混淆菌种清单可参考相应的产品说明书。(2)混合菌鉴定困难。尽管有不少研究尝试对混合培养物进行鉴定 [ 8 , 9 , 10 ] ,但尚无可靠的混合菌鉴定系统投入临床使用,目前的MALDI-TOF MS准确鉴定仍需以获得纯菌落为前提。(3)仅适用于可体外培养并形成纯菌落的病原微生物。MALDI-TOF MS目前无法用于耶氏肺孢子菌、衣原体、立克次体等微生物的鉴定。(4)数据库存在局限性。MALDI-TOF MS的微生物鉴定性能依赖于制造商数据库中菌种的覆盖程度,建库菌株的数量和来源,入库谱图的质量等 [ 3 ] 。因此,当制造商数据库(包括临床库与科研库)无法满足用户当地的菌种鉴定需求时,实验室可以通过自建库进行补充,若自建库与本品牌的科研库鉴定发生冲突,应采用基因测序进行确认,参见问题11。
推荐意见2 确定或疑似高致病性的微生物,在鉴定前需依据其生物学特征进行充分灭活,确保生物安全。
操作要点:(1)MALDI-TOF MS鉴定过程中,应根据《微生物和生物医学实验室生物安全通用准则》保证生物安全,包括对鉴定病原微生物的灭活、化学试剂的防护以及医疗废物处理等。(2)MALDI-TOF MS操作应在生物安全二级及以上实验室进行,涉及活菌操作应在二级生物安全柜内完成。(3)操作中使用的甲酸、乙腈及三氟乙酸(trifluoroacetic acid,TFA)等化学试剂,应做好通风,避免体表接触。(4)布鲁菌、炭疽芽孢杆菌、结核分枝杆菌以及疑似高致病性病原菌的质谱鉴定,需采用具有灭活效能的试剂进行相应处理,如乙醇、TFA [ 11 , 12 , 13 ] 。灭活后在二级及以上生物安全柜内使用甲酸乙腈提取法涂布靶板 [ 13 ] 。为保证生物安全,亦可增加预灭活步骤,如在平板中加入75%的乙醇溶液,完全覆盖培养物,静置30 min后挑取菌落鉴定。此外,建议对分枝杆菌额外增加高温灭活的步骤(80 ℃/90 min或95 ℃/30 min) [ 11 , 14 ] 。
问题3 不同类型病原微生物的前处理流程?
推荐意见3 推荐MALDI-TOF MS 鉴定不同类型的病原微生物时,采用适宜前处理方法进行操作,其中甲酸乙腈提取法应用范围较广。
MALDI-TOF MS 鉴定前处理的主要目的是灭活病原微生物、破坏其细胞壁及提取胞内蛋白质。不同类型微生物细胞壁的结构和成分不同,破壁难易程度有别,从而直接影响蛋白质释放。因此需要选择适当的前处理流程,主要包括:直接涂抹法、原位甲酸提取法、甲酸乙腈提取法、双甲酸法等多种方法 [ 6 ] , 图1 中总结了不同类型微生物的 MALDI-TOF MS 样品制备流程。
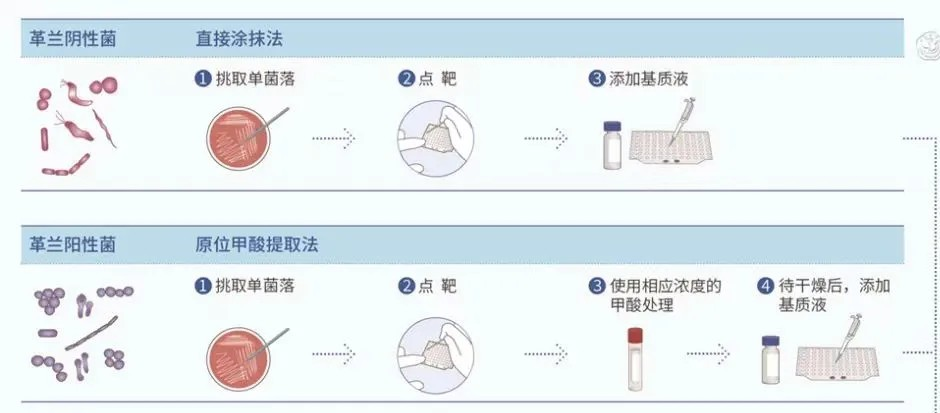
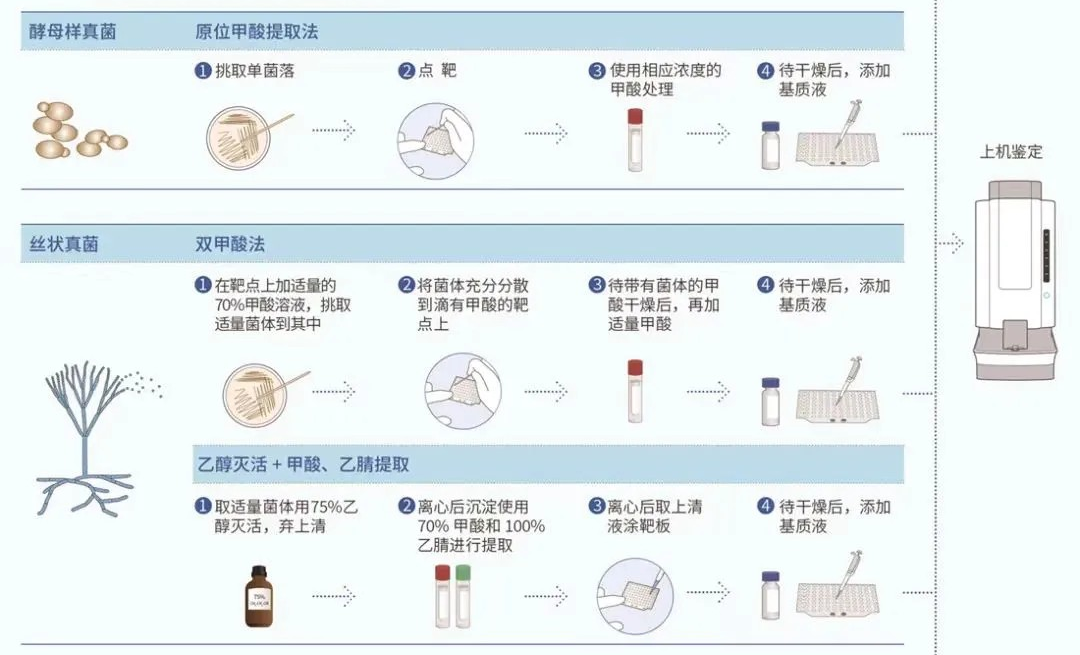
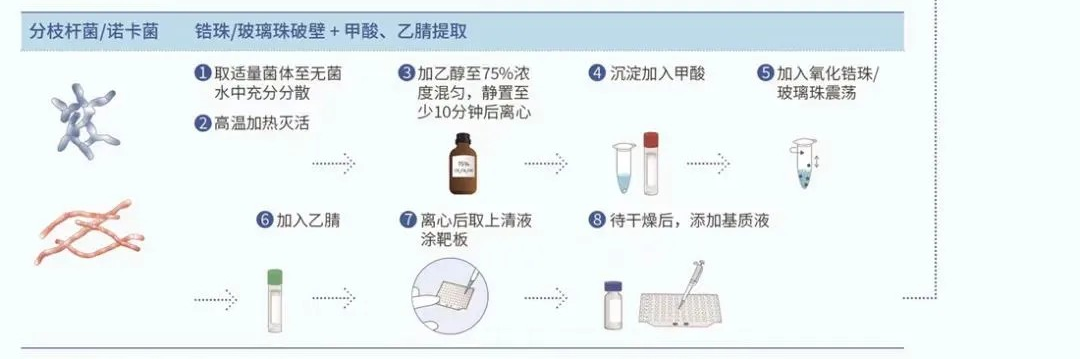
高致病性微生物的鉴定,应在灭活后采用甲酸乙腈提取法。双甲酸法能有效提升丝状真菌的检出率 [ 15 ] ,且较甲酸乙腈提取法更简单。但无法保证对真菌的充分灭活,尤其是挑菌涂抹靶板过程中孢子可能溢散,需要考虑生物安全及交叉污染风险。
部分分枝杆菌与丝状真菌等病原微生物细胞壁厚,即使采用推荐的前处理方法,谱图质量仍不理想,应摸索更适当的前处理方法,如添加超声(18 ℃下进行,40 W 峰值功率和50% 占空比超声 1 min [ 16 ] )、冻融(‒75 ℃ 30 min或‒20 ℃ 60 min,室温融化 [ 17 ] )等步骤。
问题4 培养基对MALDI-TOF MS鉴定病原微生物有什么影响?
推荐意见4 使用不同培养基通常对MALDI-TOF MS鉴定结果影响不大,推荐优选非选择性的固体培养基进行鉴定。
用固体和液体培养基获得的图谱可能存在差异,研究表明液体培养基会降低某些微生物的鉴定准确率 [ 18 , 19 , 20 ] ,但绝大部分情况下对鉴定结果影响不大 [ 3 , 6 ] 。尽管在液体培养基中微生物生长状态更为均一,但固体培养基更符合临床应用场景 [ 21 , 22 ] ,建议选择制造商推荐的培养基。
不同固体培养基对于常见病原微生物的核糖体蛋白影响甚微,对鉴定准确性影响不大,但以下原因会对图谱质量产生影响 [ 22 , 23 , 24 , 25 , 26 ] 。
培养基影响微生物蛋白质表达谱:MALDI-TOF MS蛋白质指纹图谱主要由核糖体蛋白和其他高丰度管家蛋白的信号组成。培养基对于前者影响小,但是可能会通过改变其他蛋白质的表达情况而影响谱图 [ 23 , 27 ] ,具体机制不明。
培养基成分造成的电离抑制效应:培养基含有多种选择性成分,包括抗菌药物、盐和酸碱指示剂等。盐是质谱的电离抑制剂,例如使用直涂法鉴定麦康凯培养基(MacConkey agar,MAC)培养的假单胞菌时,可能由于培养基中含有胆盐成分造成电离抑制而影响鉴定,但某些肠道分离株的鉴定似乎不受MAC成分的影响 [ 26 ] 。
培养基中的色素可影响鉴定结果:虽然暂无培养基中色素影响质谱鉴定的报道,但Buskirk等 [ 28 ] 研究发现真菌色素会抑制解吸/电离过程,电离抑制存在浓度依赖性,在高黑色素浓度(>5 000 ng/spot)下接近 100%,提示含色素的培养基如MAC可能具有类似的效果 [ 26 ] 。
血琼脂培养基中的血红蛋白可对谱图造成干扰:生长在哥伦比亚血培养基上的金黄色葡萄球菌较甘露醇盐琼脂培养基上菌落具有更多的峰 [ 27 ] ,但不会改变菌种的鉴定结果 [ 21 ] 。
问题5 哪些临床标本可直接进行鉴定?
推荐意见5 推荐MALDI-TOF MS直接鉴定血培养阳性标本,按照标准操作流程,可有效缩短标本周转时间(turnaround time,TAT),但应注意其局限性。
原则上MALDI-TOF MS鉴定需采用纯菌落,但有部分临床标本无须分纯培养即可直接进行质谱鉴定,包括血培养阳性标本、尿液标本、无菌体液标本,其中用血培养阳性标本直接鉴定较为成熟,能缩短TAT,满足临床快速诊疗的需求。
血培养阳性标本:菌体的富集是影响阳性血培养直接鉴定效率的重要因素 [ 29 , 30 ] 。通过富集技术处理阳性血培养标本后,直接用MALDI-TOF MS进行鉴定 [ 31 ] ,主要方法有短时培养法、分离胶促凝管富集法和试剂盒富集法( 图2 )。此外,需关注血培养阳性样本的涂片革兰染色结果是否为单一病原微生物,如有两种及以上形态的病原微生物,可影响鉴定结果。
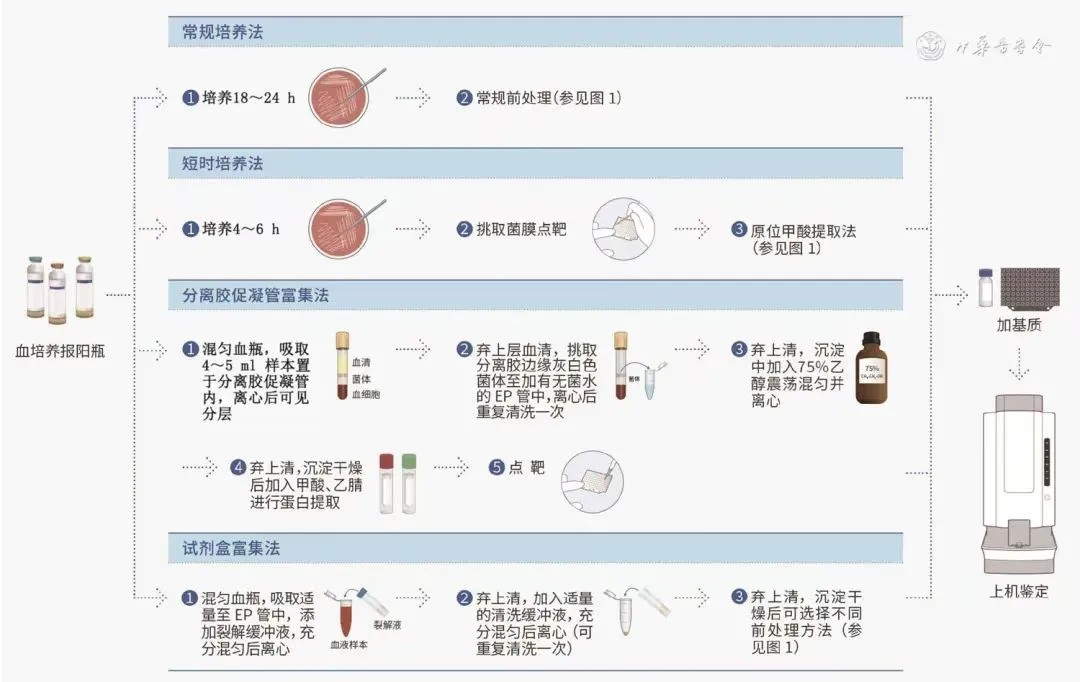
图2 血培养阳性病原微生物的基质辅助激光解吸电离飞行时间质谱鉴定方法
尿液标本:研究表明尿路感染患者的尿液中有足够的菌量(≥10 5 CFU/ml),可直接进行病原微生物质谱鉴定,建议先用尿分析仪对菌量进行评估 [ 32 ] 。同样需要关注涂片革兰染色是否为单一病原微生物。参考步骤:(1)低速(2 000~4 000× g)离心去除白细胞、细胞碎片及黏液;(2)高速(10 000~14 000× g)离心沉淀菌体;(3)无菌水清洗沉淀后用甲酸乙腈提取法进行MALDI-TOF MS上机前处理 [ 32 , 33 , 34 ] 。
无菌体液标本:脑膜炎患者的脑脊液标本的直接质谱鉴定方法报道相对较少 [ 35 , 36 ] ,主要因为标本中菌量较低,检测灵敏度无法保证。研究显示无菌体液如脑脊液 [ 37 ] 、腹腔积液 [ 38 ] 、关节滑液 [ 39 , 40 ] 标本可先接种于血培养瓶中进行培养增菌,在血培养仪报阳后进行质谱鉴定,同样能显著缩短TAT。
此外,略过分纯培养步骤,直接用原始标本进行质谱鉴定病原微生物仍存在局限性:(1)无法鉴定混合微生物;(2)标本中人体细胞干扰或菌量不足可能导致鉴定结果不可靠 [ 32 , 41 ] ,因此在进行无菌体液标本直接鉴定的同时,需要对此标本进行平行的传代培养,并在获得纯菌落后进行最终鉴定结果的确认。
03 结果分析与解读
问题6 采集到质量较差的谱图时,如何分析原因?
推荐意见6 推荐采用新鲜菌落进行MALDI-TOF MS鉴定,针对不同病原微生物的特征,选择恰当的前处理方法提高谱图质量。
合格的谱图应包含丰富的谱峰信息,体现在峰数量较多且分散、强度错落有致、分辨率较高、信噪比较高。在日常工作中,如果质控正常,采集到的谱图质量仍不理想,可能的原因如下[ 3, 6 ] 。
标本因素:(1)建议使用新鲜的菌落进行鉴定,此时微生物处于指数生长期,有利于采集到优质谱图;随生长时间延长,菌龄增加,影响谱图质量 [ 42 ] 。(2)肺炎链球菌、流感嗜血杆菌、肺炎克雷伯菌、铜绿假单胞菌、隐球菌等黏液型菌落,由于细胞壁外有荚膜,导致破壁困难,鉴定性能下降 [ 18 ] ,建议使用棉签拂去菌落表面黏液,再挑取下层菌落进行点靶。
前处理操作:若前处理方法选择不当,导致细胞壁破碎效果差,蛋白质释放不足,容易出现杂峰干扰、峰数量少、信号低等问题。
点靶操作:因操作者手法问题造成点靶质量差,常见于以下几种情况( 图3A~3D )。(1)菌量过少( 图3B )可能造成谱图信号弱。(2)菌量过多( 图3C ),涂靶过厚,容易造成谱图分辨率差、质量轴漂移等现象。(3)涂靶不均匀( 图3D ),自动采集过程中容易采空,或者厚薄不均造成结晶分布不均,影响激光激发效果,重复性差。(4)培养基成分干扰,挑取菌落时混入培养基,涂靶后鉴定容易受到培养基峰的干扰。

问题7 当谱图质量合格但鉴定结果不理想时,如何分析原因?如何确定处理方法?
推荐意见7 当谱图质量合格但鉴定结果不理想时,推荐通过校准/质控排查仪器原因,观察菌落排查标本混合菌、污染等原因,最后考虑数据库的局限性,可用自建库进行改善。
仪器原因:质量轴发生偏移,可能的原因包括未进行校准或校准不当、靶板平整度不合格、结晶不理想及其他仪器系统原因等。可通过在靶板不同区域进行质控/校准菌株的鉴定操作快速排查。当校准/质控未通过或不同区域质量轴差异较大时,需保证靶板的平整度,并及时对仪器进行校准。
标本原因:(1)混合菌或者培养物被污染。如果标本在质谱鉴定前未获得纯菌落,谱图中可能含有多菌种谱峰信息,导致鉴定失败。建议重新挑取纯菌落,或者重新通过分纯培养获得纯菌落。(2)标本间交叉污染。操作不当导致的交叉污染,如靶板清洗不充分、不同靶点之间枪头混用、标本溢出靶点等,可能导致谱图信息混杂,影响鉴定结果。建议规范操作并按照说明书正确清洗靶板。(3)培养条件不同。当待测株与建库株的培养方法不一致时,可能鉴定失败。如部分丝状真菌在不同的培养基类型、培养天数、温度等条件下,可能会对谱图产生较大的影响 [ 21 , 43 ] 。
数据库原因:(1)数据库菌种覆盖度不足。如果数据库中未包含待测菌株的菌种参考谱图,则无法正确鉴定。(2)待测菌株与数据库中同种菌株差异较大。虽然数据库中包含待测菌种,但由于亚种、地域、标本来源、是否产黏液等因素导致的同种菌株之间差异性,鉴定结果可能不理想。
问题8 单个标本重复鉴定出现不同的鉴定结果,如何解读结果及处理?
推荐意见8 单个标本重复鉴定出现不同结果,多是由于鉴定未到种水平所致。可能匹配质谱易混淆的近缘菌种,也可能是由于分辨率不足/数据库菌种缺失导致的匹配到多个低置信度的同属不同种,如有必要需重新制样或进一步补充其他方法进行区分。
多次采集/多点采集鉴定出现不同结果,考虑以下原因和相应处理流程。
近缘菌种易混淆:MALDI-TOF MS对于部分亲缘关系相近的菌种没有足够的区分度。常见的易混淆结果是复合群内的不同种,如阴沟肠杆菌复合群,包括阴沟肠杆菌、阿氏肠杆菌、霍氏肠杆菌、神户肠杆菌等,也有可能是属内多个近缘菌种,如李斯特菌属里的单核细胞增生李斯特菌、无害李斯特菌、斯氏李斯特菌、威氏李斯特菌等,甚至可能是不同属的菌株混淆,如大肠埃希菌与志贺菌属。建议关注制造商的易混提示/低分辨提示,再根据临床是否需要鉴定到种水平采取相应措施。
种特征不明显:谱图缺失种特异峰,分辨水平低,谱图与数据库中多个菌种匹配。通常体现为谱图质量不高,峰相对少,打分较低。建议采用提取法或者更充分的破壁方法进行前处理。
数据库缺少待测菌种:此时谱图可能会与数据库中存在的近缘菌种匹配,得出多个结果。通常发生在少见罕见菌种鉴定,谱图质量好,但分数不高。若多个结果属于同一个属,建议质谱报告为属水平结果,并通过基因测序等其他方法进行种水平鉴定。
混合菌和交叉污染:通常体现为不同菌种结果亲缘关系并不相近,且分数不高、峰较多。建议通过规范取样、制样来避免交叉污染;若是怀疑混合菌,进行重新分纯。
问题9 病原微生物采用不同方法鉴定,结果不一致时应如何处理?
推荐意见9 不同微生物鉴定方法学的适用性、病原谱、准确率有区别,当MALDI-TOF MS鉴定结果与其他方法不一致,推荐使用基因测序作为鉴定“金标准”。
病原微生物鉴定常见方法包括形态学、生化、MALDI-TOF MS和基因测序鉴定,对于一些肠道病原菌还需补充血清凝集试验。目前实验室采用全自动微生物生化鉴定仪和MALDI-TOF MS较为广泛,而基因测序可作为难鉴定菌的备选方案 [ 44 , 45 ] 。基因测序方法中,Sanger测序能够实现大部分常见微生物的种水平鉴定,但某些菌种(如诺卡菌、非结核分枝杆菌等),其特征核酸序列片段(如16S rRNA)分辨力有限,无法准确鉴定,常需要联合多个特殊性片段测序,甚至需要全基因组测序 [ 46 ] 。在日常的微生物鉴定时,应明确所采用方法的局限性及所要达到的鉴定水平(属/复合群/种),选用适宜的鉴定技术,必要时采用多种方法确认。
当不同方法鉴定结果不一致时,需要考虑如下因素:特定病原微生物采用不同方法学鉴定时的可信度:(1)肺炎链球菌和缓症链球菌群,质谱鉴定可能出现错误,而生化鉴定技术可作为补充 [ 6 ] ;(2)鲍曼不动杆菌复合群内菌种,生化鉴定方法尚无法有效鉴别,MALDI-TOF MS可明确区分复合群,基因测序可准确鉴定;(3)肠道致病菌,需补充血清凝集试验实现不同血清型的鉴别。
所选择方法的病原菌谱:不同鉴定方法所能覆盖的病原菌谱存在差异,基因测序>MALDI-TOF MS>生化鉴定。若鉴定结果不一致,应考虑待测菌是否在所选方法的病原菌谱内。如按蚊伊丽莎白金菌可被质谱正确鉴定,但生化鉴定卡的病原菌谱并不包括此菌种,可能被误鉴定为脑膜炎脓毒伊丽莎白金菌。
所选择方法的鉴定准确率:目前MALDI-TOF MS鉴定准确率已经接近分子方法,高于生化鉴定。不同方法结果不一致时,基因测序仍被认为是菌种鉴定的“金标准” [ 47 ] 。
问题10 不常见病原微生物的鉴定结果如何验证?
推荐意见10 Sanger测序可用于验证不常见病原微生物的质谱鉴定结果,推荐16S 核糖体RNA(16S ribosomal RNA,rRNA)(细菌)/内转录间隔区(internal transcribed spacer,ITS)(真菌)作为靶基因,当无法鉴定到种水平,需要加测其他保守基因。
对不常见病原微生物的鉴定结果,建议查询其基本信息,并采用其他方法学的复核和验证,优先选择基因测序。病原学分子鉴定技术可采取保守区核酸扩增和Sanger测序结合的方式,细菌靶基因首选16S rRNA基因,通过与数据库中已知序列比对,相似度超过98.7%为同一种 [ 48 ] ,无已知序列超过阈值则可能是新种;真菌首选ITS基因,通常使用相似度97.0%作为同种阈值 [ 49 ] 。当首选靶基因分辨率不足(不止一个种超过阈值)时,需加测其他保守基因,具体可参照临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)MM18 [ 50 ] 。
基于测序技术的快速发展和成本的有效控制,亦可采用基因组测序技术实现不常见病原微生物的准确鉴定,基于基因组序列的平均核苷酸一致性分析,与模式菌株或参考菌株比对分值超过94.0%可认定为待鉴定菌种与模式菌株菌种一致 [ 51 ] 。
问题11 哪些病原微生物鉴定到种水平有重要临床意义?
推荐意见11 临床鉴定病原微生物需要尽可能鉴定到种水平。当质谱分辨率不足时,对于影响公共健康或影响临床决策的病原微生物,推荐采用其他鉴定方法报告到种水平。
原则上临床鉴定病原微生物应尽可能鉴定到种水平。MALDI-TOF MS无法鉴定到种时,需根据临床意义判断是否可报告至复合群或属水平。如有必要到种水平,可采用改进前处理提高质谱鉴定分数、或辅以其他方法进一步鉴定。以下几种情况需报告到种水平甚至是亚种水平。
影响公共健康、与严重疾病相关的病原微生物:细菌,如炭疽芽孢杆菌、鼠疫耶尔森菌、霍乱弧菌、白喉棒杆菌、单核细胞增生李斯特菌;真菌,如新型隐球菌与格特隐球菌、耳念珠菌等需要报告到种 [ 52 ] 。
菌种间致病性存在差异的病原微生物:例如(1)肺炎链球菌是临床常见的致病菌,而口腔/缓症链球菌常被认为是定植菌 [ 53 ] 。(2)血培养常见污染菌如凝固酶阴性葡萄球菌、棒杆菌属、丙酸杆菌等,若≥2套被检出,应鉴定到种以判断其临床意义。(3)血液或无菌体液中的牛链球菌群常与肠道肿瘤密切相关,应鉴定至亚种水平 [ 54 ] 。(4)尿标本分离到的解脲棒杆菌常与肾结石相关 [ 55 ] ,而在乳腺组织、脓液分离出的克罗彭施泰特棒杆菌则与肉芽肿性乳腺炎相关 [ 56 ] ,需鉴定到种水平。(5)嗜水气单胞菌复合群常无需鉴定到种,但如该类细菌引起食源性腹泻需进行病原学溯源或引起肠外血流感染、尿路感染及组织脓肿时,应准确鉴定到种水平 [ 57 ] 。
与经验使用抗菌药物相关的病原微生物:例如鲍曼不动杆菌尽管与皮特不动杆菌或医院不动杆菌同属于一个复合群,但鲍曼不动杆菌感染患者往往表现出更高的耐药率和病死率 [ 58 , 59 , 60 ] ,需要进行区分。真菌中容易产生耐药尤其是多药耐药的菌种,例如耳念珠菌 [ 61 ] 、印度毛癣菌 [ 62 ] 、尖端赛多孢 [ 63 ] 、多育节荚孢霉 [ 64 , 65 ] 、东南亚念珠菌 [ 66 ] 等需鉴定到种。部分非结核分枝杆菌(nontuberculous mycobacteria,NTM)的质谱鉴定即使选用推荐的前处理方法仍会混淆,如设计分枝杆菌与塞内加尔分枝杆菌容易鉴定成偶发分枝杆菌,因NTM的不同菌种与临床治疗密切相关,应尽可能鉴定到种 [ 67 , 68 ] 。脓肿分枝杆菌复合群中的脓肿分枝杆菌脓肿亚种、脓肿分枝杆菌马赛亚种和脓肿分枝杆菌博莱亚种3个亚种抗菌药物治疗的效果存在显著差异,应尽可能区分到亚种水平 [ 69 ] 。
问题12 什么情况下临床可以报告到微生物复合群水平?
推荐意见12 在不影响临床决策的前提下,当MALDI-TOF MS对复合群内种的区分能力有限或是鉴定到复合群内不常见的种时,推荐将微生物鉴定结果报告到复合群水平。
对复合群内种的区分能力有限:有一种情况是MALDI-TOF MS鉴定结果即为复合群,如丁香假单胞菌复合群、黑曲霉复合群等。更常见的情况是涉及MALDI-TOF MS易混淆的一些近缘菌种,尽管结果显示鉴定到种,但由于区分能力有限,可能导致重复鉴定出现复合群中不同种的鉴定结果(参见问题8)。此时应结合临床意义,考虑报告到复合群水平,例如洋葱伯克霍尔德菌、新洋葱伯克霍尔德菌、多噬伯克霍尔德菌可报告洋葱伯克霍尔德复合群;弗劳地柠檬酸杆菌、布氏柠檬酸杆菌、杨氏柠檬酸杆菌可报告弗劳地柠檬酸杆菌复合群;趾间毛癣菌、须癣毛癣菌可报告须癣毛癣菌复合群。镰刀菌无论Sanger测序还是MALDI-TOF MS鉴定均难以准确鉴定至种,可根据MALDI-TOF MS鉴定结果报告至镰刀菌复合群水平 [ 70 ] ,如茄病镰刀菌复合群、尖孢镰刀菌复合群、藤仓镰刀菌复合群、肉色镰刀菌-木贼镰刀菌复合群、厚孢镰刀菌复合群、双孢镰刀菌复合群。
鉴定到复合群内不常见的种:当MALDI-TOF MS鉴定出复合群内较为少见的种,在经过基因测序复核后,为了协助临床决策,可考虑报告复合群水平,或是同时报告种和复合群。例如质谱鉴定出霍氏肠杆菌,可报告阴沟肠杆菌复合群 [ 6 ] ;质谱鉴定为银白色葡萄球菌,可报告为金黄色葡萄球菌复合群 [ 71 ] 。由于真菌分类学和命名的快速变化,根据最新的推荐 [ 72 ] ,临床少见真菌鉴定的报告应尽可能包含种名和复合群名,例如双希木龙念珠菌同时报告种名和希木龙复合群;波氏赛多孢报告种名和尖端赛多孢复合群。
问题13 MALDI-TOF MS对临床常见真菌的鉴定可以达到什么水平?
推荐意见13 MALDI-TOF MS可以作为临床常见真菌如念珠菌、隐球菌、曲霉菌的首选鉴定方法之一,对于鉴定不理想的部分丝状真菌,推荐结合其来源、感染部位、菌落形态、显微镜下形态等特征加以判断。
随着MALDI-TOF MS技术的发展、算法的优化以及数据库的版本更新,常见临床真菌的鉴定取得了显著的进展,特别是在某些属内(如念珠菌属、隐球菌属、镰刀菌属、曲霉属等)的近缘菌种之间,区分能力越来越强,可作为鉴别的首选方法。此外,实验室自建库可以有效提高真菌鉴定的准确率,目前MALDI-TOF MS结合自建库鉴定临床常见真菌的进展见表1 。

MALDI-TOF MS鉴定丝状真菌仍然存在一定的挑战,经常无法得到种置信的结果,可能的原因如下。
蛋白质提取困难:丝状真菌由于细胞壁成分复杂,存在较多几丁质,使得破壁困难,容易出现谱图不佳的情况,例如峰少、分辨率差等,尤其是外瓶霉、枝孢瓶霉等暗色真菌,常出现鉴定分数低,难以鉴定到种水平 [ 73 ] 。
谱图一致性差:丝状真菌在不同生长时期,菌丝和产孢阶段,蛋白质指纹图谱可能产生一定的差异 [ 43 , 88 ] 。且用不同的前处理方法,对谱图的影响也较大 [ 89 ] 。
复合群内难区分:临床丝状真菌存在许多亲缘关系相近的菌复合群/组,例如藤仓镰刀菌复合群中的层生镰刀菌和轮枝镰刀菌、须癣毛癣菌复合群中的趾间毛癣菌和须癣毛癣菌、杂色曲霉亚属中的杂色曲霉和聚多曲霉等 [ 90 , 91 ] 。与细菌、酵母及酵母样真菌相比,丝状真菌峰数量更少,特征信息更少,因此区分这些近缘菌种更加困难。
针对以上丝状真菌质谱鉴定的特点及难点,部分制造商创建了专门的真菌/丝状真菌数据库,设置有别于细菌的鉴定参数和算法,并在数据库中兼容同种丝状真菌不同前处理、生命周期不同阶段鉴定的谱图,提高了丝状真菌的鉴定水平。
尽管质谱鉴定临床真菌的可靠性在持续提升,但不同制造商的数据库存在差异,尤其是菌种覆盖度和鉴定性能差异较大,因此要求微生物专业人员结合真菌的来源、感染部位、形态学等特征对结果的准确性进行评判,以保证结果可靠性。
2.应用于抗菌药物敏感性试验(antimicrobial susceptibility tests,AST):研究表明可以通过比较是否与抗菌药物共孵育的病原菌谱图进行快速AST,理论上这类方法适用于各种类型抗菌药物与相关病原菌。MALDI Biotyper抗菌药物敏感试验快速测定法是一种半定量的快速AST试验,通过摸索合适的抗菌药物孵育浓度和时间,并用软件计算待测菌株添加或未添加抗菌药物孵育后的谱图曲线下面积(area under the curve,AUC),用以评估微生物的生长情况。如果微生物菌株敏感,由于生长受抑制,与抗菌药物孵育的谱图AUC 会低于未添加抗菌药物的对照;而对于耐药菌株,受抗菌药物影响很小,无论是否与抗菌药物共孵育,谱图的AUC相当。
直接靶板微滴生长法则是基于微量肉汤稀释法的原理,直接在靶板上将病原微生物与折点浓度的抗菌药物一起孵育,通过谱图的鉴定分数来评估病原菌生长情况,从而判断菌株的耐药性/敏感性。
3.进行微生物分型:(1)聚类分析。通过制造商提供的科研分析软件,可以选择聚类算法对同种不同株的谱图进行种水平以下的分析和比较,通过距离的远近衡量同种菌株之间的同源性和异质性,可用于亚种和血清型的区分、识别高毒力和耐药菌株、院感溯源的研究等 [ 97 , 98 ] 。(2)机器学习,智能分型。基于MALDI-TOF MS数据的积累,机器学习可以通过建模对谱图进行更复杂的分析和更精细的区分,除了上文提到的耐药预测,还可用于近缘菌种/亚种的区分 [ 99 ] 、毒力的预测 [ 100 ] 等其他分型应用。
此外,随着全自动化微生物学检验流水线技术的发展,MALDI-TOF MS作为其中重要组成部分,在质谱前处理及靶板制备实现了自动化,有利于减少人工误差,更充分发挥质谱高效、高通量的特点,优化工作流程的同时有效缩短TAT [ 101 ] 。
参考文献(略)














